Summary
Rachis, petiole and leaflet-blade explants of potato were either not irradiated or irradiated with different doses of X-rays. The effect of X-ray dose, explant type and explant position on adventitious shoot formation of in vitro cultured explants and on subsequent root formation of subcultured shoots was examined. The in vitro method of vegetative propagation resulted in the production of 3167 plantlets from 457 explants (with subcultured shoots), at least 4 months after incubation.
Zusammenfassung
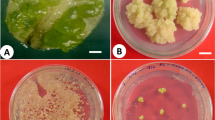
Hauptachsen-, Blattstiel- und Fiederblatt-Gewebestückchen von Kartoffeln wurden von verschiedenen Stellen isoliert und entweder nicht bestrahlt oder mit verschiedenen Dosen von X-Strahlen bestrahlt. Die isolierten Pflanzenteile wurden auf MS-Nährböden ergänzt mit 0,8 % Agar, 5 % Saccharose, BAP und IAA (1 mg/l) und GA3 (10 mg/l), kultiviert. Die Gewebe wurden einer Tageslänge von 14 h, einer Temperatur von 20 °C und 70–80 % relativer Feuchtigkeit ausgesetzt. Die ersten Nebentriebe erschienen 3–6 Wochen nach der Inkubation (Abb. 6 und 7). Bei 94,7 % der nicht befallenen Kontrollgewebe wurden neue Triebe (≥1 cm) gebildet (Tabelle 1a). Bestrahlung verspätete und reduzierte die Neubildung von Trieben; diese Reduktion schien mehr oder weniger unabhängig vom Typ des Gewebes und proportional zur Dosis der X-Strahlen zu sein. Die Gewebestelle beeinflusste die Nebentriebbildung nur wenig (Tabelle 1b). Die ersten Triebe (≥1 cm) wurden aus den Kontrollgeweben abgeschnitten und für die Bewurzelung auf MS-Nährboden, ergänzt mit 0,5 % Agar, 2 % Saccharose und 0,1 mg/l IAA, 19 Wochen nach Inkubation nachgebaut. Die Anzahl der grossen, nachgebauten Triebe pro Gewebe nahm mit steigender Dosis der X-Strahlen ab (Tabelle 2a). Die Anzahl der grossen, nachgebauten Triebe (≥1 cm) pro Kontroll-Fiederblattgewebe (13,9) war etwas höher als die Anzahl pro Hauptachsen- und Blattstielgewebe der Kontrolle (12,5). Die Gewebestelle beeinflusste die Anzahl der grossen nachgebauten Triebe nicht deutlich (Tabelle 2b).
Die ersten nachgebauten Triebe brachten nach einer Woche Wurzeln hervor, und die meisten Triebe hatten nach 2 Wochen Wurzeln entwickelt. Die bewurzelten Triebe und die kräftigsten unbewurzelten Triebe wurden für die spätere Produktion in Erde verpflanzt und nachfolgend als Pflänzchen ins Glashaus überführt.
Es wurde kein signifikanter Einfluss von Gewebetyp und Gewebestelle in bezug auf die Anzahl der eingetopften Triebe und der übersiedelten Pflänzchen festgestellt.
Gewebe sowohl von Hauptachse und Blattstiel als auch vom Fiederblatt brachten bei steigender Dosis von X-Strahlen eine abnehmende Anzahl von eingetopften Trieben und übersiedelten Pflänzchen. Schliesslich wurden 158 von 225 Trieben (70,2 %), die von Hauptachsen- und Blattstielgeweben der Kontrolle stammten, ins Glashaus überführt, und 203 von 251 Trieben (80,9 %) aus Fiederblattgewebe der Kontrolle. In den Kontrollverfahren wurden von jedem Gewebestück 8,8 Pflänzchen von Hauptachsenund Blattstielgeweben versetzt und 11,3 Pflänzchen von Fiederblattgeweben. Der Durchschnitt pro Gewebestückchen mit grossen Trieben betrug 10,0 Pflänzchen. Kontrollpflänzchen erhielt man ungefähr fünf Monate nach dem Schneiden der Gewebestücke; bei Bestrahlung mit steigender Dosis von X-Strahlen wurden zunehmend längere Zeiten benötigt.
Résumé
Des explants de rachis, de pétiole et de limbe foliaire prélevés en différents endroits ont été soit non irradiés, soit irradiés à différentes doses de rayons X. Les isolats ont été mis en culture sur des milieux MS, additionnés d'agar à 0,8 %, de 5 % de sucrose, de 1 mg/l de BAP et IAA et 10 mg/l de GA3. Les explants sont soumises à une durée du jour de 14 h, une température de 20 °C et 70–80 % d'humidité relative. L'initiation des premières pousses adventives apparait 3 à 6 semaines après incubation (fig. 6 et 7). Sur 94,7 % des explants témoins et non-contaminés les pousses (≥1 cm) ont été régénérées (tableau 1a). L'irradiation a à la fois retardé et réduit la régénération des pousses; cette réduction s'est révélée plus ou moins indépendante du type d'explant, mais proportionnelle à la dose de rayons X. La position de l'explant n'a que légèrement modifié la formation de pousses adventives (tableau 1b). Les premières pousses (≥1 cm) ont été excisées des explants témoins puis mises en culture pour l'enracinement sur milieu MS, additionné de 0,5 % d'agar, 2 % de sucrose et 0,1 mg/l de IAA 19 semaines après incubation. Le nombre de grandes pousses repiquées par explant a diminué lorsque la dose de rayons X a augmenté (tableau 2a).
Le nombre de grandes (≥1 cm) pousses repiquées par explant témoin de limbe (13,9) était un peu plus grand que celui par explant témoin de rachis et de pétiole (12,5). La position de l'explant n'a pas modifié nettement le nombre de grandes pousses repiquées (tableau 2b).
Les premières pousses repiquées ont régénéré des racines 1 semaine après et la plupart des pousses ont eu des racines au bout de 2 semaines. Les pousses avec racines et les plus vigoureuses des pousses sans racines ont été transplantées dans le sol pour la dernière production et un transfert ultérieur des jeunes plantes en serre.
Nous n'avons observé aucun effet significatif du type d'explant et de la position de l'explant sur le nombre moyen de pousses transplantées et de jeunes plantes transférées.
Les explants de rachis, de pétiole aussi bien que ceux de limbe ont produit moins de pousses transplantées et de jeunes plantes transférées avec les doses croissantes de rayons X. En définitive, 158 sur 225 pousses (70,2 %) issues de rachis et de pétiole témoins, et 203 sur 251 pousses (80,9 %) issues d'explants de limbe témoin ont été transférées. Dans les traitements témoins, pour chaque explant de rachis et de pétiole 8,8 jeunes plantes ont été transférées contre 11,3 pour les explants de limbe, ce qui fait en moyenne 10 jeunes plantes par explant avec de grandes pousses. Les jeunes plantes témoin ont été obtenues environ cinq mois après l'excision des explants; avec irradiation il fallait des délais de plus en plus longs aux doses croissantes de rayons X.
Similar content being viewed by others
References
Broertjes, C. & A. M. van Harten, 1978. Application of mutation breeding methods in the improvement of vegetatively propagated crops. An interpretive literature review. Elsevier Scientific Publishing Company, Amsterdam, 316 pp.
Broertjes, C., B. Haccius & S. Weidlich, 1968. Adventitious bud formation on isolated leaves and its significance for mutation breeding.Euphytica 17: 321–344.
Broertjes, C., S. Roest & G. S. Bokelmann, 1976. Mutation breeding ofChrysanthemum morifolium Ram. using in vivo and in vitro adventitious bud techniques.Euphytica 25: 11–19.
Murashige, T. & F. Skoog, 1962. A revised medium for rapid growth and bio assays with tobacco tissue cultures.Physiologia Pl. 15: 473–497.
Roest, S., 1977. Vegetative propagation in vitro and its significance for mutation breeding.Acta Hort. 78: 349–359.
Roest, S. & G. S. Bokelmann, 1975. Vegetative propagation ofChrysanthemum morifolium Ram. in vitro.Scientia Hort. 3: 317–330.
Roest, S. & G. S. Bokelmann, 1976. Vegetative propagation ofSolanum tuberosum L. in vitro.Potato Res. 19: 173–178.
Author information
Authors and Affiliations
Rights and permissions
About this article
Cite this article
Roest, S., Bokelmann, G.S. In vitro adventitious bud techniques for vegetative propagation and mutation breeding of potato (Solanum tuberosum L.). 1. Vegetative propagation in vitro through adventitious shoot formation. Potato Res 23, 167–181 (1980). https://doi.org/10.1007/BF02356267
Accepted:
Published:
Issue Date:
DOI: https://doi.org/10.1007/BF02356267