Summary
Using 32P and 35S as tracers the uptake of phosphate and sulphate anions by Elodea densa has been studied in external concentrations of 10-8 to 5×10-3 m at varying temperatures between 2 and 18°C and under different conditions of light. The uptake of phosphate was investigated in the fractions inogranic phosphate (Pi), TCA-soluble acid-labile organic phosphate (Plo), TCA-soluble stabile organic phosphate (Pso) and TCA-insoluble phosphate (Pu). The main portion of the phosphate taken up was found in the Pi fraction under all conditions, but especially under conditions of low pH, low temperatures and high phosphate concentration.
In the case of phosphate light was found to increase the overall uptake at intermediary concentrations, the stimulation being greatest in the fractions Pso and Pu, less in Plo and least in Pi. At high and low concentrations the stimulation by light disappeared. At low temperatures the stimulation was considerably smaller, but it showed the same dependence on external concentration and even became negative at low concentrations.
Light stimulates the uptake of sulphate, too, the stimulation being dependent on external concentration in the same way as it is with phosphate. However, at low temperatures this stimulation of sulphate uptake by light is considerably higher than at high temperatures.
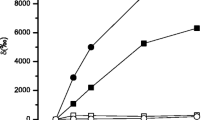
Variation of external concentrations of phosphate and sulphate ions results in similar isotherms of uptake for both anions. The isotherms exhibit a linear dependence at low concentrations, a saturation curve at intermediary concentrations and a further rise at high concentrations. Using enzyme kinetics one obtains hyperbolic curves indicating that at least two different processes are taking place.
The dependence on temperature within a limited range can be approximated by an Arrhenius equation and is described by the apparent energies of activation E app which are found to be 15.8±2.9 and 24.8±2.8 kcal/mol for the phosphate and sulphate uptake respectively at intermediary concentrations. In the case of phosphate E app is higher for the incorporation into Pu and Pso and considerably lower but very similar for both the incorporation into Plo and Pi. In this respect E app parallels the stimulation by light.
The energies of activation of uptake for both anions are strongly dependent on external concentration and reach a maximum at intermediary concentrations.
Considering the energetics with respect to internal and external concentrations and the value of the membrane potential, net uptake of both ions must occur with an expenditure of free energy, thus representing an active process in the whole range of external concentrations.
However, from the concomitant changes in the stimulation by light and the energies of activation, the isotherms of uptake are interpreted as being composed of three concentration ranges with the following steps being rate-limiting: the diffusion in the unstirred layer at low concentrations, the active uptake at intermediary concentrations and a considerable contribution of diffusive influx at high external concentrations. This diffusive uptake can occur with tracer flux (influx) only, not with net uptake. Thus it is not contradictory to the energetics of anion uptake.
On the basis of this interpretation active and passive fluxes at high concentration are separated and permeability coefficients are estimated from the passive fluxes. According to this sparation the energies of activation of diffusive transport in the cellular membrane are calculated as 5 and 8 kcal/mol (Q 10=1.35 or 1.6) for phosphate and sulphate respectively. The phosphate fluxes are considerably higher than the sulphate fluxes.
From the values of E app it is deduced that a major component of Plo, possibly ATP, might participate in active phosphate uptake.
The isotherms compare well with isotherms of anion uptake by other species so that the results may have some bearing on the interpretation of anion uptake in general.
Zusammenfassung
An Elodea densa wurde die Aufnahme von Phosphat-und Sulfationen im Konzentrationsbereich zwischen 10-8 und 5×10-3 m bei Temperaturen zwischen 2 und 18°C im Licht und im Dunkeln untersucht. Die Phosphataufnahme wurde in den Fraktionen anorganisches Phosphat (Pi), TCA-lösliche labile (Plo) sowie stabile (Pso) organische Phosphorsäureverbindungen und TCA-unlösliche Verbindungen (Pu) untersucht. Die Hauptmenge des aufgenommenen Phosphates findet sich unter allen Bedingungen, besonders aber bei niedrigem pH, tiefen Temperaturen oder hohen Phosphatkonzentrationen in der Pi-Fraktion.
Licht fördert die H2PO -4 -Aufnahme und den Einbau von Phosphat in die einzelnen Fraktionen, am stärksten bei den Fraktionen Pu und Pso, weniger bei Plo, am wenigsten bei Pi. Die Lichtförderung der H2PO -4 -Aufnahme hat ein Maximum bei mittleren Konzentrationen, sie nimmt mit fallender Temperatur ab.
Licht fördert dienfalls die SO -4 -Aufnahme, auch hier tritt ein Maximum bei mittleren Konzentrationen auf, mit fallender Temperatur wird die Lichtförderung jedoch größer.
Die Konzentrationsabhängigkeit der Aufnahme der beiden Anionen weist komplexe Isothermen auf, die einander sehr ähnlich sind. Die Isothermenform bei höherer und tiefer Temperatur ist weitgehend gleich.
Die Temperaturabhängigkeit gehorcht innerhalb eines beschränkten Temperaturbereiches einer Arrheniusbeziehung. Die Aktivierungsenergien der Phosphat-und Sulfationenaufnahme zeigen ein Maximum bei mittleren Konzentrationen, ihre Werte sind hier etwa 15,8±2,9 bzw. 24,8±2,8 kcal/mol. Die Aktivierungsenergie des Phosphateinbaues ist bei den Fraktionen Pu und Pso am größten, kleiner bei Plo und Pi.
Energetischen Betrachtungen zufolge kann die Nettoaufnahme der beiden Anionen im gesamten Konzentrationsbereich nur endergonisch und somit aktiv erfolgen.
Aufgrund der Veränderung der Lichtwirkung und der Aktivierungsenergien mit der Konzentration werden drei Bereiche der Konzentrationsabhängigkeit unterschieden, in denen folgende Vorgänge als geschwindigkeitsbestimmend bei der Bruttoaufnahme angesehen werden: bei niedrigen Konzentrationen Diffusion in der nichtgerührten Schicht (Filmkinetik), bei mittleren Konzentrationen die aktive Aufnahme und bei hohen Konzentrationen die aktive sowie eine passive Aufnahme durch Diffusion.
Dieser Interpretation zufolge werden bei einer Konzentration von 5×10-3 m die Bruttoaufnahme in ihre Anteile aufgeteilt und die Werte des passiven und des aktiven Influxes sowie der Permeabilitätskoeffizienten abgeschätzt. Die Aktivierungsenergie des passiven Transportes ergibt sich dann zu 5 bzw. 8 kcal/mol bei H2PO -4 bzw. SO --4 .
Die Übereinstimmung der Aktivierungsenergien der Aufnahme von Phosphat in die Plo-und die Pi-Fraktion wird als ein Hinweis dafür interpretiert, daß möglicherweise ATP an der Phosphationenaufnahme beteiligt ist.
Similar content being viewed by others
Literatur
Arisz, W. H.: Influx and efflux by leaves of Vallisneria spiralis. I. Active uptake and permeability. Protoplasma (Wien) 57, 5–26 (1963).
—, and H. H. Sol: Influence of light and sucrose on the uptake and transport of chloride in Vallisneria leaves. Acta bot. neerl. 5, 218–246 (1956).
Bieleski, R. L., siehe G. G. Laties, in: Cellular membranes in development, ed. M. Locke, p. 311. New York: Academic Press 1964.
Böszörményi, Z., and E. Cseh: Studies of ion-uptake by using halide ions, changes in the relationships between ions depending on concentration. Physiol. Plant. 17, 81–90 (1964).
Bogen, H. J.: In W. Ruhland, Handbuch der Pflanzenphysiologie, Bd. II. Berlin-Göttingen Heidelberg: Springer 1956.
Brauner, L.: Die Permeabilität der Zellwand. In: W. Ruhland, Handbuch der Pflanzenphysiologie, Bd. II. Berlin-Göttingen-Heidelberg: Springer 1956.
Brdička, R.: Grundlagen der physikalischen Chemie. Berlin: VEB Deutscher Verlag d. Wissenschaften 1958.
Briggs, G. E., A. B. Hope, and R. N. Robertson: Electrolytes and plant cells, ed. W. O. James, Oxford: Blackwells 1961.
Dainty, J.: Ion transport and electrical potentials in plant cells. Annu. Rev. Plant Physiol. 13, 379–402 (1962).
Danielli, J. F.: Zit. bei Briggs, Hope and Robertson, p. 16 (1961).
Elzam, O. E., D. W. Rains, and E. Epstein: Ion transport kinetics in plant tissue: Complexity of the chloride absorption iso therm. Biochem. biophys. Res. Commun. 15, 273–276 (1964).
Epstein, E.: Mineral nutrition of plants: Mechanisms of uptake and transport. Annu. Rev. Plant Physiol. 7, 1–24 (1956).
Epstein, E., and C. E. Hagen: A kinetic study of the absorption of alkali cations by barley roots. Plant Physiol. 27, 457–474 (1952).
—, D. W. Rains, and O. E. Elzam: Resolution of dual mechanism of potassium absorption by barley roots. Proc. nat. Acad. Sci. (Wash.) 49, 684–692 (1963).
Foote, B., and J. B. Hanson: Ion uptake by soybean root tissue depleted of calcium by ethylenediaminetetraacetic acid. Plant Physiol. 39, 450–460 (1964).
Forti, G., and B. Parisi: Evidence for the occurrence of cyclic photophosphorylation in vivo. Biochim. biophys. Acta (Amst.) 71, 1–6 (1963).
Frank, E.: Vergleichende Untersuchungen zum Kalzium-, Kalium- und Phosphathaushalt von Grünalgen, I. Flora (Jena) 152, 139–156 (1962).
Gerlach, E., u. B. Deuticke: Eine einfache Methode zur Mikrobestimmung von Phosphat in der Papierchromatographie. Biochem. Z. 337, 477–479 (1963).
Goodman, J., and A. Rothstein: The active transport of phosphate into yeast cell. J. Gen. Physiol. 40, 915–923 (1957).
Hagen, C. E., and H. T. Hopkins: Ionic species in orthophosphate absorption by barley roots. Plant Physiol. 30, 193–199 (1955).
—, J. E. Legget, and P. C. Jackson: The sites of orthophosphate uptake by barley roots. Proc. nat. Acad. Sci. (Wash.) 43, 496–506 (1957).
Helfferich, F.: Ionenaustauscher. I. Grundlagen. Weinheim, Bergstraße: Verlag Chemie 1959.
Hofstee, B. H. J.: On the evaluation of the constants V mand KM in enzyme reactions. Science 116, 329–331 (1952).
Jeschke, W. D., u. H. A. Stuart: Diffusion und Permeation von Gasen in Hochpolymeren in Abhängigkeit vom Kristallisationsgrad und der Temperatur. Z. Naturforsch. 16a, 37–50 (1961).
Kylin, A.: The accumulation of sulfate in isolated leaves as affected by light and, darkness. Bot. Notiser 113, 49–81 (1960).
—: Sulphate uptake and metabolism in Scenedesmus as influenced by phosphate carbon dioxide and light. Physiol. Plant. 17, 422–433 (1964).
Laties, G. G., I. R. MacDonald, and J. Dainty: Influence of counterion on the absorption isotherm for chloride at low temperature. Plant Physiol. 39, 254–262 (1964).
Leggett, J. E.: Entry of phosphate into yeast cell. Plant Physiol. 36, 277–284 (1961).
—, and E. Epstein: Kinetics of sulfate absorption by barley roots. Plant physiol. 31, 222–226 (1956).
—, R. A. Olsen, and B. D. Spangler: Cation absorption by Baker's yeast as a pasive process. Proc. nat. Acad. Sci. (Wash.) 48, 1949–1956 (1962).
Lookeren Campagne, R. N. Van: Light-dependent chloride absorption in Vallisneria leaves. Acta bot. neerl. 6, 543–582 (1957).
MacRobbie, E. A. C.: Factors affecting the fluxes of potassium and chloride ions in Nitella translucens. J. gen. Physiol. 47, 859–877 (1964a).
MacRobble, E. A. C. Vortrag, gehalten auf dem Xth Internat. Botanical Congr. Edinburgh 1964b.
—: The nature of the coupling between light and active ion transport in Nitella translucens. Biochem. biophys. Acta (Amst.) 94, 64–73 (1965).
Marrê, E., G. Forti, R. Bianchetti, and B. Parisi: Utilization of photosynthetic chemical energy for metabolic processes different from CO2 fixation. Coll. intern. Centr. nat. Rech. Sci. 119, 557–570 (1963).
Marschner, H., u. I. Günther: Ionenaufnahme und Zellstruktur bei Gerstenzurzeln in Abhängigkeit von der Calziumversorgung. Z. Pflanzenernähr., Düng., Bodenkunde 107, 19–32 (1964).
—, u. G. Michael: Untersuchungen über Schwefelabscheidung und Sulfataustausch an Weizenwurzeln. Z. Pflanzenernähr., Düng., Bodenkunde 91, 29–44 (1960).
Mengel, K., u. H. Marschner: Die aktive Ionenaufnahme durch die Pflanzenzelle. Z. Pflanzenernähr., Düng., Bodenkunde 100, 193–207 (1963).
Michael, G., u. H. Marschner: Untersuchungen über die Phosphatabscheidung aus Pflanzenwurzeln mit Hilfe von P32. Z. Pflanzenernähr., Düng., Bodenkunde 80, 1–18 (1958).
Miyachi, S., and H. Tamiya: Distribution and turnover of phosphate compounds in grwing Chlorella cells. Plant and Cell Physiol. 2, 405–414 (1961).
Netter, H.: Theoretische Biochemie. Berlin-Göttingen-Heidelberg: Springer 1959.
Ohlenbusch, H. D.: Die Kinetik der Wirkung von Effectoren auf stationäre Fermentsysteme. Berlin-Göttingen-Heidelberg: Springer 1962.
Palmcrantz, P.: Über Züchtung von Elodea densa. Beitr. Biol. Pflanz. 29, 220–231 (1953).
Rains, D. W., W. E. Schmidt, and E. Epstein: Absorption of cations by roots. Effects of hydrogen ions and essential role of calcium. Plant Physiol. 39, 274–278 (1964).
Simonis, W.: Untersuchungen zur Photosynthese-Phosphorylierung an intakten Algenzellen. Ber. dtsch. bot. Ges. 74, Sondernummer, 5–13 (1964).
—, u. K. H. Grube: Untersuchungen über den Zusammenhang zwischen Phosphathaushalt und Photosynthese. Z. Naturforsch. 7b, 194–196 (1952).
— F. J. Kuntz u. W. Urbach: Probleme der Phosphataufnahme in Abhängigkeit von Licht und Dunkelheit bei Ankistrodesmus. Vorträge Gesamtgeb. Bot. N.F. 1, 139–148 (1962).
—, u. W. Urbach: Über eine Wirkung von Natriumionen auf die Phosphataufnahme und die lichtabhängige Phosphorylierung von Ankistrodesmus braunii. Arch. Mikrobiol. 46, 265–286 (1963).
Spanner, D. C.: Introduction to thermodynamics. London and New York: Academic Press 1964.
Sutcliffe, J. F.: Mineral salts absorption in plants. Oxford-London-New York-Paris: Pergamon Press 1962.
Ullrich, W., W. Urbach, K. A. Santarius u. U. Heber: Z. Naturforsch., im Druck (1965).
Ulrich, B.: Die Wechselbeziehung von Boden und Pflanze in physikalisch-chemischer Betrachtung. Stuttgart: Ferdinand Enke 1961.
—, u. H. E. Oberländer: Theoretische Betrachtungen über die enzymkinetische Interpretation der Ionenaufnahme durch die Pflanze. Plant and Soil 21, 26–36 (1964).
Umrath, K.: Elektrophysiologische Probleme. In: W. Ruhland, Handbuch der Pflanzenphysiologie, Bd. II. Berlin-Göttingen-Heidelberg: Springer 1956.
Urbach, W., u. W. Simonis: Wirkung von Hemmstoffen auf die lichtabhängige Phosphorylierung bei Ankistrodesmus braunii. Vorträge Gesamtgeb. Bot. N.F. 1, 139–148 (1962).
——: Inhibitor studies on the photophosphorylation in vivo by unicellular algae (Ankistrodesmus) with antimycin A, HO QNO, salicylaldoxime, and DCMU Biochem. biophys. Res. Commun. 17, 39–45 (1964).
Weichart, G.: Untersuchungen über Phosphorylierungsprozesse bei der Photosynthese höherer Pflanzen (Elodea) unter Verwendung von radioaktivem Phosphat. Planta (Berl.) 56, 262–289 (1960).
Weigl, J.: Die Bedeutung der energiereichen Phosphate bei der Ionenaufnahme durch Wurzeln. Planta (Berl.) 60, 307–321 (1963).
—: Uber den Zusammenhang von Photophosphorylierung und aktiver Ionenaufnahme. Z. Naturforsch. 19b, 845–851 (1964).
Willenbrink, J.: Lichtabhängiger 35S-Einbau in organische Binding in Tomatenpflanzen. Z. Naturforsch. 19b, 356–367 (1964).
Yamada, Y. S., H. Wittwer, and M. J. Bukovac: Penetration of ions through isolated cuticules. Plant Physiol. 39, 28–32 (1964).
Yanagita, T.: Paper read at the meeting of Biochem. Soc., Japan, Nov. 1957, Tokyo 1957.
Author information
Authors and Affiliations
Rights and permissions
About this article
Cite this article
Jeschke, W.D., Simonis, W. Über die Aufnahme von Phosphat-und Sulfationen Durch Blätter von Elodea Densa und Ihre Beeinflussung Durch Licht, Temperatur und Aussenkonzentration. Planta 67, 6–32 (1965). https://doi.org/10.1007/BF00391290
Received:
Issue Date:
DOI: https://doi.org/10.1007/BF00391290