Abstract
The Western honey bee, Apis mellifera, is the most important animal pollinator in agriculture worldwide providing more than 90% of the commercial pollination services. Due to the development in agriculture the demands for honey bee pollination are steadily increasing stressing the pollination capacity of the global managed honey bee population. Hence, the long-term decline of managed honey bee hives in Europe and North-America is of great concern and stimulated intensive research into the possible factors presumably causing honey bee colony collapse. We here present a four-year study involving more than 1200 bee colonies from about 120 apiaries which were monitored for the entire study period. Bee samples were collected twice a year to analyze various pathogenic factors including the ectoparasitic mite Varroa destructor, fungi (Nosema spec., Ascosphaera apis), the bacterium Paenibacillus larvae, and several viruses. Data on environmental factors, beekeeping management practice, and pesticides were also collected. All data were statistically analyzed in respect to the overwintering mortality of the colonies. We can demonstrate for several factors that they are significantly related to the observed winter losses of the monitored honey bee colonies: (i) high varroa infestation level, (ii) infection with deformed wing virus (DWV) and acute bee paralysis virus (ABPV) in autumn, (iii) queen age, and (iv) weakness of the colonies in autumn. No effects could be observed for Nosema spec. or pesticides. The implications of these findings will be discussed.
Zusammenfassung
Die Honigbiene Apis mellifera ist weltweit der wichtigste Bestäuber in der Landwirtschaft und nach aktuellen Schätzungen wird der globale Bedarf an kommerzieller Bestäubung weiter steigen. Dadurch stellt der seit Jahren zu beobachtende stetige Rückgang der Bienenvölker in Nord-Amerika und Europa ein ernsthaftes Problem für die Landwirtschaft dar. Für die Abnahme der Bienenvölker werden neben wirtschaftlichen Faktoren vor allem periodisch auftretende Völkerverluste verantwortlich gemacht, für die aber eine eindeutige Ursachenanalyse bisher fehlt.
Zur Ursachenaufklärung von Winterverlusten führten wir von 2004 bis 2009 ein Monitoringprojekt durch, in dem mehr als 1200 Bienenvölker auf 125 über ganz Deutschland verteilten Bienenständen (Abb. 1) kontinuierlich beprobt und kontrolliert wurden. Die beteiligten „Monitoringimker“ stellten hierfür 10 ihrer Völker zur Verfügung und lieferten Daten zu Honigerträgen, Wanderungen und Ablegerbildung. Mitarbeiter der Bieneninstitute nahmen zweimal im Jahr Bienenproben für Krankheitsuntersuchungen (Nosema spec, Varroa destructor, 4 verschiedene Bienenviren) sowie Bienenbrotproben für Rückstandsuntersuchungen. Die Stärke der Bienenvölker wurde bei der Ein- und Auswinterung bestimmt; als „Überwinterungsverlust“ wurden Völker definiert, die tot waren bzw. nicht genug Bienen für eine erfolgreiche Frühjahrsentwicklung aufwiesen.
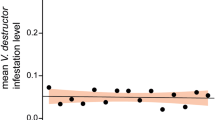
Die Winterverluste schwankten zwischen 3,5 % und 15,2 % (Abb. 3) mit ungleicher Verteilung innerhalb der beteiligten Imker (Abb. 4). Für die Ursachenanalyse wurden die überlebenden mit den zusammengebrochenen Völkern verglichen. Dabei zeigten sich die größten und hochsignifikanten (P < 0,000001, U-Test) Unterschiede beim Varroabefall der Bienen im Oktober (Tab. III, Abb. 5). Ebenfalls hochsignifikante Unterschiede ergaben sich für die Bienenviren DWV (P < 0,00001) und APBV (P < 0,0039), nicht jedoch für KBV, SBV und den Nosemabefall (Tab. V). Erstaunlicherweise waren Völker mit jungen Königinnen signifikant seltener von Winterverlusten betroffen als mit älteren Königinnen (Tab. VI), während z. B. Beutenmaterial oder Rähmchenmaß keine Rolle spielten.
Bei den insgesamt in drei Jahren auf Pestizidrückstände untersuchten 215 Bienenbrotproben wurden insgesamt über 50 Wirkstoffe (von 256) nachgewiesen, die meisten im Spurenbereich. Häufig wurden mehrere Wirkstoffe gefunden und nur etwas mehr als 20 % der Proben waren frei von messbaren Rückständen (Tab. VII). Neonikotinoide wurden nur in einer einzigen Probe nachgewiesen. Es konnte keine Korrelation von Rückstandswerten mit Winterverlusten festgestellt werden. Es gab auch keinen Zusammenhang zwischen der Überwinterung von Bienenvölkern und dem Umfang des zuvor eingetragenen Rapshonigs (Abb. 6).
Unser Projekt zeigt, dass der Varroabefall im Herbst (zusammen mit den assoziierten Sekundärinfektionen) eine Hauptursache für Überwinterungsverluste darstellt. Eine konsequente Varroabehandlung und starke Bienenvölker mit jungen Königinnen sind daher die wichtigste Empfehlung, um Winterverlusten vorzubeugen. Ein zusätzlicher Einfluss der übrigen Faktoren kann nicht ausgeschlossen werden, hierfür sind aber modifizierte Versuchsansätze notwendig.
Similar content being viewed by others
References
Aizen M.A., Harder L.D. (2009) The global stock of domesticated honey bees is growing slower than agricultural demand for pollination, Curr. Biol. 19, 915–918.
Aizen M., Garibaldi L., Cunningham S., Klein A. (2008) Long-term global trends in crop yield and production reveal no current pollination shortage but increasing pollinator dependency, Curr. Biol. 18, 1572–1575.
Akyol E., Yeninar H., Karatepe M., Karatepe B., Özkök D. (2007) Effects of queen ages on Varroa (Varroa destructor) infestation level in honey bee (Apis mellifera caucasica) colonies and colony performance, Ital. J. Anim. Sci. 6, 143–149.
Amdam G.V., Hartfelder K., Norberg K., Hagen A., Omholt S.W. (2004) Altered physiology in worker honey bees (Hymenoptera: Apidae) infested with the mite Varroa destructor (Acari: Varroidae): A factor in colony loss during overwintering? J. Econ. Entomol. 97, 741–747.
Bailey L., Ball B.V. (1991) Honey Bee Pathology, Academic Press, New York, London.
Bailey L., Gibbs A.J., Woods R.D. (1963) Two viruses from adult honey bees (Apis mellifera Linnaeus), Virology 21, 390–395.
Baker A., Schroeder D. (2008) Occurrence and genetic analysis of picorna-like viruses infecting worker bees of Apis mellifera L. populations in Devon, South West England, J. Invertebr. Pathol. 98, 239–242.
Bakonyi T., Farkas R., Szendroi A., Dobos-Kovacs M., Rusvai M. (2002) Detection of acute bee paralysis virus by RT-PCR in honey bee and Varroa destructor field samples: rapid screening of representative Hungarian apiaries, Apidologie 33, 63–74.
Ball B.V. (1983) The association of Varroa jacobsoni with virus diseases of honey bees, Exp. Appl. Acarol. 19, 607–613.
Ball B.V. (1989) Varroa jacobsoni as a virus vector, In Present status of varroatosis in Europe and progress in the varroa mite control, Office for Official Publications of the European Communities, Luxembourg.
Ball B.V., Allen M.E. (1988) The prevalence of pathogens in honey bee (Apis mellifera) colonoes infested with the parasitic mite Varroa jacobsoni, Ann. Appl. Biol. 113, 237–244.
Barnett E.A., Charlton A.J., Fletcher M.R. (2007) Incidents of bee poisoning with pesticides in the United Kingdom, 1994–2003, Pest Manag. Sci. 63, 1051–1057.
Berenyi O., Bakonyi T., Derakhshifar I., Köglberger H., Nowotny N. (2006) Occurence of six honey bee viruses in diseased Austrian apiaries, Appl. Environ. Microbiol. 72, 2414–2420.
Bowen-Walker P.L., Martin S.J., Gunn A. (1999) The transmission of deformed wing virus between honey bees (Apis mellifera L.) by the ectoparasitic mite Varroa jacobsoni Oud., J. Invertebr. Pathol. 73, 101–106.
Chauzat M.P., Higes M., Martin-Hernandez R., Meana A., Cougoule N., Faucon J.P. (2007) Presence of Nosema ceranae in French honey bee colonies, J. Apic. Res. 46, 127–128.
Chen Y.P., Huang Z.Y. (2010) Nosema ceranae, a newly identified pathogen of Apis mellifera in the U.S.A. and Asia, Apidologie 41, 364–374.
Cox-Foster D.L., Conlan S., Holmes E.C., Palacios G., Evans J.D., Moran N.A., Quan P.-L., Briese S., Hornig M., Geiser D.M., Martinson V., vanEngelsdorp D., Kalkseitn A.L., Drysdale L., Hui J., Zhai J., Cui L., Hutchison S., Simons J.F., Egholm M., Pettis J.S., Lipkin W.I. (2007) A metagenomic survey of microbes in honey bee colony collapse disorder, Science 318, 283–287.
Currie R.W., Gatien P. (2006) Timing acaricide treatments to prevent Varroa destructor (Acari: Varroidae) from causing economic damage to honey bee colonies, Can. Entomol. 138, 238–252.
de Miranda J.R., Fries I. (2008) Venereal and vertical transmission of deformed wing virus in honey bees (Apis mellifera L.), J. Invertebr. Pathol. 98, 184–189.
de Miranda J.R., Genersch E. (2010) Deformed wing virus, J. Invertebr. Pathol. 103, S48-S61.
de Miranda J., Cordoni G., Budge G. (2010) The acute bee paralysis virus — Kashmir bee virus — Israeli acute paralysis virus complex, J. Invertebr. Pathol. 103, S30-S47.
Decourtye A., Devillers J., Cluzeau S., Charreton M., Pham-Delègue M.H. (2004) Effects of imidacloprid and deltamethrin on associative learning in honey bees under semi-field and laboratory conditions, Ecotoxicol. Environ. Saf. 57, 410–419.
Decourtye A., Lacassie E., Pham-Delègue M.H. (2003) Learning performances of honey bees (Apis mellifera L.) are differentially affected by imidacloprid according to the season, Pest Manag. Sci. 59, 269–278.
Delaplane K.S., Hood W.M. (1999) Economic threshold for Varroa jacobsoni Oud. in the southeastern USA, Apidologie 30, 383–395.
Desneux N., Decourtye A., Delpuech J.M. (2007) The sublethal effects of pesticides on beneficial arthropods, Annu. Rev. Entomol. 52, 81–106.
Ellis J., Evans J.D., Pettis J. (2010) Reviewing colony losses and Colony Collapse Disorder in the United States, J. Apic. Res. 49, 134–136.
Fries I., Camazine S., Sneyd J. (1994) Population dynamics of Varroa jacobsoni: a model and a review, Bee World 75, 5–28.
Fries I., Ekbohm G., Villumstad E. (1984) Nosema apis, sampling techniques and honey yield, J. Apic. Res. 23, 102–105.
Fries I., Hansen H., Imdorf A., Rosenkranz P. (2003) Swarming in honey bees (Apis mellifera) and Varroa destructor population development in Sweden, Apidologie 34, 389–398.
Genersch E. (2005) Development of a rapid and sensitive RT-PCR method for the detection of deformed wing virus, a pathogen of the honey bee (Apis mellifera), Vet. J. 169, 121–123.
Giray T., Kence M., Oskay D., Döke M.A., Kence A. (2010) Colony losses survey in Turkey and causes of bee deaths, Apidologie, in press, DOI 10.1051/apido/2009077.
Gisder S., Aumeier P., Genersch E. (2009) Deformed wing virus (DWV): viral load and replication in mites (Varroa destructor), J. Gen. Virol. 90, 463–467.
Gnädinger F. (1984) Auswinterungsverluste bei Bienenvölkern in Baden, Allg. Deutsche Imkerzeitung 18, 297–299.
Goodwin R.M., Taylor M.A., Mcbrydie H.M., Cox H.M. (2006) Drift of Varroa destructor-infested worker honey bees to neighbouring colonies, J. Apic. Res. 45, 155–156.
Greatti M., Milani N., Nazzi F. (1992) Reinfestation of an acaricide-treated apiary by Varroa jacobsoni Oud., Exp. Appl. Acarol. 16, 279–286.
Higes M., Garcia-Palencia P., Martin-Hernandez R., Meana A. (2007) Experimental infection of Apis mellifera honey bees with Nosema ceranae (Microsporidia), J. Invertebr. Pathol. 94, 211–217.
Higes M., Martín-Hernández R., Botías C., Garrido Bailón E., González-Porto A.V., Barrios L., del Nozal M.J., Bernal J.L., Jiménez J.J., García Palencia P., Meana A. (2008) How natural infection by Nosema ceranae causes honey bee colony collapse, Environ. Microbiol. 10, 2659–2669.
Higes M., Martín-Hernández R., Garrido-Bailón E., González-Porto A.V., García-Palencia P., Meana A., del Nozal M.J., Mayo R., Bernal J.L. (2009) Honey bee colony collapse due to Nosema ceranae in professional apiaries, Environ. Microbiol. Rep. 1, 110–113.
Higes M., Martin R., Meana A. (2006) Nosema ceranae, a new microsporidian parasite in honey bees in Europe, J. Invertebr. Pathol. 92, 93–95.
Highfield A.C., El Nagar A., Mackinder L.C.M., Noël L.M.-L.J., Hall M.J., Martin S.J., Schroeder D.C. (2009) Deformed wing virus implicated in overwintering honey bee colony losses, Appl. Environ. Microbiol. 75, 7212–7220.
Horn H. (2009) Die wichtigsten Trachtpflanzen und ihre Sortenhonige, Teil 1: Raps. Allg. Deutsche Imkerzeitung 43, 13–15.
Iqbal J., Müller I. (2007) Virus infection causes specific learning deficits in honey bee foragers, Proc. R. Soc. B 274, 1517–1521.
Johnson R.M., Ellis M.D., Mullin C.A., Frazier M. (2010) Pesticides and honey bee toxicitiy — U.S.A., Apidologie 41, 312–331.
Johnson R.M., Evans J.D., Robinson G.E., Berenbaum M.R. (2009) Changes in transcript abundance relating to colony collapse disorder in honey bees (Apis mellifera), Proc. Natl. Acad. Sci. USA 106, 14790–14795.
Karise R. (2007) Foraging behaviour and physiology of bees: impact of insecticides, PhD-thesis, Estonian University of Life Sciences, Tartu, Estonia, 123 p.
Klee J., Besana A.M., Genersch E., Gisder S., Nanetti A., Tam D.Q., Chinh T.X., Puerta F., Ruz J.M., Kryger P., Message D., Hatjina F., Korpela S., Fries I., Paxton R.J. (2007) Widespread dispersal of the microsporidian Nosema ceranae, an emergent pathogen of the western honey bee, Apis mellifera, J. Invertebr. Pathol. 96, 1–10.
Klein A.-M., Vaissiere B.E., Cane J.H., Steffan-Dewenter I., Cunningham S.A., Kremen C., Tscharntke T. (2007) Importance of pollinators in changing landscapes for world crops, Proc. R. Soc. B 274, 303–313.
Liebig G. (2001) How many varroa mites can be tolerated by a honey bee colony? Apidologie 32, 482–484.
Maori E., Lavi S., Mozes-Koch R., Gantman Y., Edelbaum O., Tanne E., Sela I. (2007) Isolation and characterization of IAPV, a dicistrovirus affecting honey bees in Israel: evidence for intra- and inter-species recombination, J. Gen. Virol. 88, 3428–3438.
Maori E., Paldi N., Shafir S., Kalev H., Tsur E., Glick E., Sela I. (2009) IAPV, a bee-affecting virus associated with Colony Collapse Disorder can be silenced by dsRNA ingestion, Insect Mol. Biol. 18, 55–60.
Martin-Hernandez R., Meana A., Garcia-Palencia P., Marin P., Botias C., Garrido-Bailon E., Barrios L., Higes M. (2009) Effect of temperature on the biotic potential of honey bee microsporidia, Appl. Environ. Microbiol. 75, 2554–2557.
Martin S.J. (2001) The role of Varroa and viral pathogens in the collapse of honey bee colonies: a modelling approach, J. Appl. Ecol. 38, 1082–1093.
Martin-Hernandez R., Meana A., Prieto L., Salvador A.M., Garrido-Bailon E., Higes M. (2007) Outcome of colonization of Apis mellifera by Nosema ceranae, Appl. Environ. Microbiol. 73, 6331–6338.
Meixner M.D., Illies I., Büchler R., Wallner K. (2009) Pesticide use in rape seed culture — are residues in honey unavoidable? Apidologie 49, 669.
Moncharmont F.X.D., Decourtye A., Hennequet-Hantier C., Pons O., Pham-Delègue M.H. (2003) Statistical analysis of honey bee survival after chronic exposure to insecticides, Environ. Toxicol. Chem. 22, 3088–3094.
Moritz R.F.A., de Miranda J., Fries I., Le Conte Y., Neumann P., Paxton R.J. (2010) Research strategies to improve honey bee health in Europe, Apidologie 41, 227–242.
Morse R.A., Calderone, N.W. (2000) The value of honey bee pollination in the United States, Bee Culture 128, 1–15.
Oldroyd B.P. (2007) What’s killing American honey bees? PLoS Biology 5, e168.
Pettis J.S., Delaplane K.S. (2010) Coordinated responses to honey bee decline in U.S.A., Apidologie 41, 256–263.
Pham-Delègue M.H., Decourtye A., Kaiser L., Devillers J. (2002) Behavioural methods to assess the effects of pesticides on honey bees, Apidologie 33, 425–432.
Potts S.G., Roberts S.P.M., Dean R., Marris G., Brown M.A., Jones H.R., Neumann P., Settele J. (2010) Declines of managed honey bees and beekeepers in Europe, J. Apic. Res. 49, 15–22.
Renz M., Rosenkranz P. (2001) Infestation dynamics and reinvasion of Varroa destructor mites in honey bee colonies kept isolated and in groups, Apidologie 32, 492–494.
Rosenkranz P., Kirsch R., Renz R. (2006) Population dynamics of honey bee colonies and varroa tolerance: a comparison between Uruguay and Germany, In: 7th Encontro sobre Abelhas, USP, Ribeirão Preto, Brazil.
Shen M., Yang X., Cox-Foster D., Cui L. (2005) The role of varroa mites in infections of Kashmir bee virus (KBV) and deformed wing virus (DWV) in honey bees, Virology 342, 141–149.
Siede R., König M., Büchler R., Failing K., Thiel H.-J. (2008) A real-time PCR based survey on acute bee paralysis virus in German bee colonies, Apidologie 39, 650–661.
Stoltz D.B., Shen X.-R., Boggis C., Sisson G. (1995) Molecular diagnosis of Kashmir bee virus infection, J. Apic. Res. 34, 153–160.
Strange J.P., Sheppard, W.S. (2001) Optimum timing of miticide applications for control of Varroa destructor (Acari: Varroidae) in Apis mellifera (Hymenoptera: Apidae) in Washington State, USA, J. Econ. Entomol. 94, 1324–1331.
Tentcheva D., Gauthier L., Zappulla N., Dainat B., Cousserans F., Colin M.E., Bergoin M. (2004) Prevalence and seasonal variations of six bee viruses in Apis mellifera L. and Varroa destructor mite populations in France, Appl. Environ. Microbiol. 70, 7185–7191.
Topolska G., Gajda A., Hartwig A. (2008) Polish honey bee colony losses during the winter of 2007/ 2008, J. Apic. Sci. 52, 95–104.
vanEngelsdorp D., Evans J.D., Donovall L., Mullin C., Frazier M., Frazier J., Tarpy D.R., Hayes J., Pettis J.S. (2009a) “Entombed Pollen”: A new condition in honey bee colonies associated with increased risk of colony mortality, J. Invertebr. Pathol. 101, 147–149.
vanEngelsdorp D., Evans J.D., Saegerman C., Mullin C., Haubruge E., Nguyen B.K., Frazier M., Frazier J., Cox-Foster D., Chen Y., Underwood R., Tarpy D.R., Pettis J.S. (2009b) Colony collapse disorder: a descriptive study, PLoS One 4, e6481.
vanEngelsdorp D., Hayes J. Jr., Underwood R.M., Pettis J. (2008) A survey of honey bee colony losses in the U.S., fall 2007 to spring 2008, PLoS ONE 3, e4071.
vanEngelsdorp D., Underwood R., Caron D., Hayes J. (2007) An estimate of managed colony losses in the winter of 2006–2007: A report commissioned by the apiary inspectors of America, Am. Bee J. 147, 599–603.
Williams I.H. (1994) The dependences of crop production within the European Union on pollination by honey bees, Agric. Zool. Rev. 6, 229–257.
Yang X., Cox-Foster D.L. (2005) Impact of an ectoparasite on the immunity and pathology of an invertebrate: Evidence for host immunosuppression and viral amplification, Proc. Natl. Acad. Sci. USA 102, 7470–7475.
Yue C., Genersch E. (2005) RT-PCR analysis of Deformed wing virus in honey bees (Apis mellifera) and mites (Varroa destructor), J. Gen. Virol. 86, 3419–3424.
Yue C., Schröder M., Bienefeld K., Genersch E. (2006), Detection of viral sequences in semen of honey bees (Apis mellifera): Evidence for vertical transmission of viruses through drones, J. Invertebr. Pathol. 92, 93–96.
Yue C., Schröder M., Gisder S., Genersch E. (2007) Vertical transmission routes for Deformed wing virus of honey bees (Apis mellifera), J. Gen. Virol. 88, 2329–2336.
Author information
Authors and Affiliations
Corresponding author
Additional information
Manuscript editor: Marla Spivak
These authors contributed equally.
Rights and permissions
About this article
Cite this article
Genersch, E., von der Ohe, W., Kaatz, H. et al. The German bee monitoring project: a long term study to understand periodically high winter losses of honey bee colonies. Apidologie 41, 332–352 (2010). https://doi.org/10.1051/apido/2010014
Received:
Revised:
Accepted:
Issue Date:
DOI: https://doi.org/10.1051/apido/2010014