Abstract
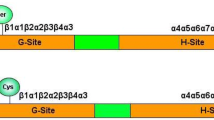
In order to transform cytosolic fructose-1,6-bisphosphatases (FBPase)(EC 3.1.3.11) into potential reductively-modulated chloroplast-type enzymes, we have constructed four chimeric FBPases, which display structural viability as deduced by previous modelling. In the X1-type BV1 and HL1 chimera the N-half of cytosolic sugar beet (Beta vulgaris L.) and human FBPases was fused with the C-half of the pea (Pisum sativum L.) chloroplast enzyme, which carries the cysteine-rich light regulatory sequence. In the X2-type BV2 and HL2 chimera this regulatory fragment was inserted in the corresponding site of the sugar beet cytosolic and human enzymes. Like the plant cytosolic FBPases, the chimeric enzymes show a low rise of activity by dithiothreitol. Both BV1 and BV2, but not HL1 and HL2, display a negligible activation by Trxf, but neither of them by Trxm. Antibodies raised against the pea chloroplast enzyme showed a positive reaction against the four chimeric FBPases and the human enzyme, but not against the sugar beet one. The four chimera display typical kinetics of cytosolic FBPases, with Km values in the 40–140 μM range. We conclude the existence of a structural capacity of cytosolic FBPases for incorporating the redox regulatory cluster of the chloroplast enzyme. However, the ability of these chimeric FBPases for anin vitro redox regulation seems to be scarce, limiting their use from a biotechnology standpoint inin vivo regulation of sugar metabolism.
Resumen
Con el objetivo de transformar fructosa-1,6-bisfosfatasas (FBPasa)(EC 3.1.3.11) citosólicas en otras de características cloroplastídicas potencialmente modulables por reducción, se han construido cuatro FBPasas quiméricas, cuyo modelaje previo las define como estructuralmente viables. En las quimeras llamadas de tipo X1, BV1 y HL1, las mitades N-terminal de la FBPasa citosólica de remolacha azucarera (Beta vulgaris L.) y humana se fusionaron con la mitad C-terminal de la FBPasa cloroplastídica de guisante (Pisum sativum L.), que lleva la secuencia, rica en cisteina, responsable de la regulación por luz de la enzima. En las denominadas tipo X2, BV2 y HL2, dicho fragmento regulatorio se insertó en el lugar correspondiente de las FBPasas citosólica de remolacha y humana. Como ocurre con las FBPasas citosólicas de plantas, las cuatro enzimas quiméricas mostraron un bajo aumento de actividad por DTT. Al mismo tiempo las quimeras BV1 y BV2, pero no las HL1 y HL2, exhibieron una escasa activación por tiorredoxinaf (Trxf), mientras que ninguna de ellas por Trxm. Anticuerpos frente a la enzima cloroplastídica de guisante mostraron una reacción positiva (Western) frente a las FBPasas quiméricas y humana, pero no frente a la enzima citosólica de remolacha. Las cuatro quimeras exhibieron cinéticas características de FBPasas citosólicas, con valores de Km en el intervalo 40–140 μM. De todo ello se deduce una capacidad estructural de las FBPasas citosólicas para incorporar la secuencia de la enzima cloroplastídica responsable de la regulación por reducción. Sin embargo, la capacidad de estas FBPasas quiméricas para una regulación rédox, al menosin vitro, parece ser escasa, lo que puede limitar su uso biotecnológicopara la regulaciónin vivo del metabolismo de los azúcares en plantas.
Similar content being viewed by others
Abbreviations
- cDNA:
-
complementary deoxyribonucleic acid
- dNTP:
-
deoxynucleotide phosphate
- FBPase:
-
fructose-1,6-bisphosphatase
- IPTG:
-
isopropyl-α-D-thiogalactoside
- PCR:
-
polymerase chain reaction
- Trx:
-
thioredoxin
References
Anderson, L. E., Li, D., Prakash, N. and Stevens, F. J. (1995):Planta,196, 118–124.
Anderson, L. E., Li, D., Nehrlich, S. C., Hill, M. H. and Stevens F. J. (1997):Plant Sci.,128, 23–30.
Baier, D. and Latzko, E. (1975):Biochim. Biophys. Acta,396, 141–148.
Bradford, M. M. (1976):Anal. Biochem.,72, 248–254.
Buchanan, B. B., Schürmann, P. and Kalberer, P. P. (1971):J. Biol. Chem.,246, 5952–5959.
Cazalis, R., Pagano, E., López Gorgé, J. and Chueca, A. (2001):Aust. J. Plant Physiol.,28, 1–7.
Chiadmi, M., Navaza, A., Miginiac-Maslow, M., Jacquot, J. P. and Cherfils, J. (1999):EMBO J.,18, 6809–6815.
Chueca, A., Sahrawy, M., Pagano, E. A. and López Gorgé, J. (2002):Photosynth. Res.,74, 235–249.
Cseke, C., Balogh, A., Wong, J. H., Buchanan, B. B., Stitt, M., Herzog, B. and Heldt, H. W. (1984):Trends Biochem. Sci.,9, 533–535.
Cséke, C. and Buchanan, B. B. (1986):Biochim. Biophys. Acta,853, 43–63.
Daie, J. (1993):Photosynth. Res.,38, 5–14.
Dzugaj, A. and Kochman, M. (1980):Biochim. Biophys. Acta,614, 407–412.
El-Maghrabi, M. R., Gidh-Jain, M., Austin, L. R. and Pilkis, S. J. (1993):J. Biol. Chem.,268, 9466–9472.
Fonollá, J., Hermoso, R., Carrasco, J. L., Chueca, A., Lázaro, J. J., Prado, F. E. and López Gorgé, J. (1994):Plant Physiol.,104, 381–386.
Frishman, D. and Argos, P. (1995):Proteins,23, 566–579.
Guex, N. and Peitsch, M. C. (1997):Electrophoresis,18, 2714–2723.
Hermoso, R., Chueca, A., Lázaro, J. J. and López Gorgé, J. (1987):Photosynth. Res.,14, 269–278.
Hermoso, R., Castillo, M., Chueca, A., Lázaro, J. J., Sahrawy, M. and López Gorgé, J. (1996):Plant Mol. Biol.,30, 455–465.
Hertig, C. M. and Wolosiuk, R. A. (1980):Biochem. Biophys. Res. Commun.,97, 325–333.
Herzog, B., Stitt, M. and Heldt H. W. (1984):Plant Physiol.,75, 561–565.
Jacquot, J. P. (1984):Physiol. Vég.,22, 487–507.
Jacquot, J. P., López-Jaramillo, J., Chueca, A., Cherfils, J., Lemaire, S., Chedozeau, B., Miginiac-Maslow, M., Decottignies, P., Wolosiuk, R. and López-Gorgé, J. (1995):Eur. J. Biochem.,229, 675–681.
Jacquot, J. P., López Jaramillo, J., Miginiac-Maslow, M., Lemaire, S., Cherfils, J., Chueca, A. and López Gorgé, J. (1997):FEBS Lett.,401, 143–147.
Khayat, E., Harn, C. and Daie, J. (1993):Plant Physiol.,101, 57–64.
Laemmli, U. K. (1970):Nature,227, 680–685.
Lázaro, J. J., Chueca, A., López Gorgé, J. and Mayor, F. (1974):Phytochemistry,13, 2455–2461.
Lázaro, J. J., Chueca, A., López Gorgé, J. and Mayor, F. (1975):Phytochemistry,14, 2579–2583.
López Jaramillo, J., Chueca, A., Jacquot, J. P., Hermoso, R., Lázaro, J. J., Sahrawy, M. and López Gorgé, J. (1997):Plant Physiol.,114, 1169–1175.
McDonell, M. W., Simon, M. N. and Studier, F. W. (1977):J. Mol. Biol.,110, 119–146.
Meyer, Y., Miginiac-Maslow, M., Schürmann, P. and Jacquot, J. P. (2002): In “Protein-Protein Interactions in Plant Biology”. (McManus, M. T., Laing, W. A. and Allan, A. C., eds.). Sheffield Academic Press, Sheffield (UK). pp. 1–29.
Morgenstern, B., Dress, A. and Werner, T. (1996):Proc. Natl. Acad. Sci. USA,93, 12098–12103.
Plá, A. and López Gorgé, J. (1981):Biochim. Biophys. Acta,636, 113–118.
Prado, F. E., Lázaro, J. J. and López Gorgé, J. (1991):Plant Physiol.,96, 1026–1033.
Raines, C. A., Lloyd, J. C. and Dyer, T. (1991):Photosynth. Res.,27, 1–14.
Sahrawy, M., Chueca, A., Hermoso, R., Lázaro, J. J. and López Gorgé J. (1990):Planta,182, 319–324.
Stec, B., Abraham, R., Giroux, E. and Kantrowitz, E. R. (1996):Protein Sci.,5, 1541–1553.
Towbin, H., Staehelin, T. and Gordon, J. (1979):Proc. Natl. Acad. Sci. USA,76, 4350–4354.
Villeret, V., Huang, S., Zhang, Y., Xue, Y. and Lipscomb, W. N. (1995):Biochemistry,34, 4299–4306.
Wangensteen, O. S., Chueca, A., Hirasawa, M., Sahrawy, M., Knaff, D. B. and López Gorgé, J. (2001):Biochim. Biophys. Acta,1547, 156–166.
Zhang, Y., Liang, J. Y., Huang, S., Ke, H. and Lipscomb, W. N. (1993):Biochemistry,32, 1844–1857.
Zimmermann, G., Kelly, G. and Latzko, E. (1976):Eur. J. Biochem.,70, 361–367.
Zimmermann, G., Kelly, G. and Latzko, E. (1978):J. Biol. Chem.,253, 5952–5956.
Author information
Authors and Affiliations
Corresponding author
Rights and permissions
About this article
Cite this article
Cazalis, R., Chueca, A., Sahrawy, M. et al. Construction of chimeric cytosolic fructose-1,6-bisphosphatases by insertion of a chloroplastic redox regulatory cluster. J. Physiol. Biochem. 60, 7–21 (2004). https://doi.org/10.1007/BF03168216
Received:
Issue Date:
DOI: https://doi.org/10.1007/BF03168216