Abstract
The columnar epithelial cells of the mucus gland begin to synthesize secretory material in the late pupal stage, and this material gradually accumulates in the lumen, beginning soon after emergence of the adult drones. Histochemical tests demonstrated secretory activity in the epithelial cells and revealed the biochemical nature of the secretions as a mixture of proteins, carbohydrates and lipids. Total proteins, lipids and carbohydrates were detected in concentrations of 333.2 ± 13.883, 208.60 ± 11.69 and 44.82 ± 2.94 μg/mg, respectively, showing that proteins form the major constituents of the mucus gland secretory material. SDS-PAGE of mucus gland secretory material revealed about 15 proteins of molecular weight ranging from 2.5 to 151.2 kDa. Three proteins of 45, 43 and 37 kDa were stained intensely and can be considered as the major class of mucus proteins.
Zusammenfassung
Obwohl Apis cerana indica in Indien die weitverbreitetste und am häufigsten in der Bienenhaltung anzutreffende Biene ist, sind unsere Kenntnisse über ihre Fortpflanzungsphysiologie nur beschränkt. Ziel der vorliegenden Studie war es demzufolge, die Struktur der Mucusdrüse und die Synthese und Zusammensetzung ihres Sektets mittels histologischer, histochemischer und biochemischer Methoden zu untersuchen.
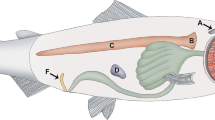
Die Mucusdrüsen (MD) von A. cerana indica sind milchigweiße, sackartige Strukturen von erdnussartiger zweiteiliger Form und einem großen Lumen. Jede Drüse wird durch eine Verengung in ein schmales distales und ein weites proximales Teilstück unterteilt. Die proximalen Teilstücke der beiden Drüsen bilden einen sackförmigen Ausgang in den jeweiligen medianen Abschnitt der lateralen Samenleiter. Die beiden lateralen Samenleiter sind kurz und laufen in einem medianen gemeinsamen Samenleiter zusammen (Abb. 1).
Die Wand der MD besteht aus einem inneren Epithel und einer äußeren Muskellage, die von einem Mesenthelium umkleidet ist. Die Epithelzellen sind große, Drüsenzellen von säulenartigem Format, die eine einzige Zellage bilden. Die runden Zellkerne liegen zentral und die Perikaryen weisen granuläre Zytoplasmaeinschlüsse auf. Im distalen Abschnitt der MD besteht die Muskellage aus einer inneren Ringmuskel- und einer äußeren Längsmuskelschicht, während die Muskulatur im proximalen Abschnitt von einer inneren und äusseren Längsmuskel- und einer mittleren Ringmuskellage gebildet wird (Abb. 2).
Während der Entwicklung von der Puppe zur adulten Bienen nimmt die MD an Gewicht, Länge und Durchmesser zu (Abb. 3). Eine Größenzunahme war auch für die Kerne der Epithelzellen zu sehen, von 6,98 ± 0,35 μm bei späten Puppen auf 10,50 ± 0,48 μm bei adulten Drohnen (Abb. 4).
In den Epithelzellen der MD war ab dem späten Puppenstadium die Synthese von sekretorischem Material zu sehen, das bereits kurz nach dem Schlüpfen der adulten Drohnen im Lumen der Drüsen akkumulierte. Histochemische Tests gaben Aufschluss über die sekretorische Aktivität und die biochemische Zusammensetzung des Sekrets als seine Mischung aus Proteinen, Kohlenhydraten und Lipiden (Abb. 5 und Tab. I). Bei einem Gesamtproteingehalt von 333,2 ± 13,8 μg/mg stellen Proteine die Hauptkomponente des Sekrets dar, das zudem 208,6 ± 11,7 μg/mg Lipide und 44,8 ± 2,9 μg/mg Kohlenhydrate enthält (Tab. II). In SDS-Polyacrylamidgelen ließen sich elektrophoretisch 15 Proteinbanden auftrennen, mit Molekülmassen von 2,5 bis 151,2 kDa, wobei drei Proteinbanden von 45, 43 und 37 kDa besonders hervortraten und dementsprechend die Hauptproteine des Mucusdrüsensekrets darstellen (Abb. 6).
Das komplexe Proteinmuster lässt auf eine Multifunktionalität des Drüsensekrets schließen, das eine Rolle spielen könnte sowohl im Spermatransfer, der Spermienkapazitierung, der Spermienlagerung und Energieproduktion, wie auch in der Oocytenreifung und anderen bei Bienen beschriebenen postkopulatorischen Aktivitäten.
Similar content being viewed by others
References
Baer B., Maile R., Schmid-Hempel P., Morgan E.D., Jones G.R. (2000) Chemistry of a mating plug in Bumblebees, J. Chem. Ecol. 26, 1869–1875.
Baer B., Morgan E.D., Schmid-Hempel P. (2001) A nonspecific fatty acid within the bumblebee mating plug prevents females from remating, Proc. Natl. Acad. Sci. USA 98, 3926–3928.
Bishop G.H. (1920) Fertilization in the honeybee. I. The male sexual organs: their histological structure and physiological functioning, J. Exp. Zool. 31, 225–265.
Blum M.S., Bumgarner J.E., Taber S. (1967) Composition and possible significance of fatty acids in the lipid classes in honey bee semen, J. Insect Physiol. 13, 1301–1308.
Blum M.S., Glowska Z., Taber S. (1962) Chemistry of the drone honey bee reproductive system. II. Carbohydrates in the reproductive organs and semen, Ann. Entomol. Soc. Am. 55, 135–139.
Chen P.S. (1984) The functional morphology and biochemistry of insect male accessory glands and their secretions, Annu. Rev. Entomol. 29, 233–255.
Colonello N.A., Hartfelder K. (2003) Protein content and pattern during mucus gland maturation and its ecdysteroid control in honeybee drones, Apidologie 34, 257–267.
Colonello N.A., Hartfelder K. (2005) She’s my girlmale accessory gland products and their function in the reproductive biology of social bees, Apidologie 36, 231–244.
Cruz-Landim C., Dallacqua R.P. (2005) Morphology and protein pattern of honeybee drone accessory glands, Genet. Mol. Res. 4, 473–481.
Dubois M., Gilles K.A., Hamilton J.K., Rebers P.A., Smith F. (1956) Colorimetric method for determination of sugars and related substances, Analyt. Chim. 28, 350–356.
Frings C.S., Dunn R.T. (1970) A colorimetric method for determination of total serum lipids based on sulfo-vanilin reaction, Am. J. Clin. Pathol. 53, 89–91.
Gillott C. (1988) Arthropoda-Insecta, in: Adiyodi K.G., Adiyodi R.G. (Eds.), Reproductive Biology of Invertebrates, Vol. III, Wiley, New York, pp. 319–471.
Gillott C. (1996) Male insect accessory glands: functions and control of secretory activity, Invertebr. Reprod. Dev. 30, 199–205.
Gillott C. (2003) Male accessory gland secretion: modulators of female reproductive physiology and behavior, Annu. Rev. Entomol. 48, 163–184.
Happ G.M. (1984) Structure and development of male accessory glands in insects, in: King R.C., Akai H. (Eds.), Insect Ultrastructure, Plenum, New York, pp. 365–396.
Ivanova E. (2000) Organ specificity of water-soluble proteins during drone (Apis mellifera L.) ontogenesis, Apidologie 31, 671–677.
Ivanova E., Popov P., Dobrovolov I. (2000) Electrophoretic study of water-soluble proteins during the honeybee (Apis mellifera L.) ontogenesis, Apidologie 31, 679–687.
Kapil R.P. (1962) Anatomy and histology of the male reproductive system of Apis indica (Apidae, Hymenoptera), Insect. Soc. 9, 73–90.
Koeniger G. (1984) Funktionsmorphologische Befunde bei der Kopulation der Honigbiene (Apis mellifera L.), Apidologie 15, 189–204.
Koeniger G. (1986a) Reproduction and mating behaviour, in: Rinderer T.E. (Ed.), Bee Genetics and Breeding, Academic Press, San Diego, pp. 255–280.
Koeniger G. (1986b) Mating sign and multiple mating in the honey bee, Bee World 67, 141–150.
Koeniger G. (1991) Diversity in Apis mating systems, Westview Press, pp. 199–211.
Koeniger G., Hänel H., Wissel M., Herth W. (1996) Cornual gland in the honeybee drone (Apis mellifera L.): structure and secretion, Apidologie 27, 145–156.
Koeniger N., Koeniger G., Wongsiri S. (1989) Mating and sperm transfer in Apis florae, Apidologie 21, 413–418.
Laemmli U.K. (1970) Cleavage of structural proteins during assembly on the head of bacteriophage T4, Nature 227, 680–685.
Leather S.R., Hardie J. (1995) Insect Reproduction, CRC Press, Boca Raton, Florida, USA.
Lowry O.L., Rosebrough N.J., Farr A.L., Randall R.J. (1951) Protein measurement with the folin phenol reagent, J. Biol. Chem. 193, 265–275.
Melo G.A.R., Buschini M.L.T., Campos L.A.O. (2001) Ovarian activation in Melipona quadrifasciata queens triggered by mating plug stimulation (Hymenoptera, Apidae), Apidologie 32, 355–361.
Mindt B. (1962) Untersuchungen über das Leben der Drohnen, insbesondere Ernährung und Geschlechtsreife, Z. Bienenforsch. 6, 9–33.
Moors L., Spaas O., Koeniger G., Billen J. (2005) Morphological and ultrastructural changes in the mucus glands of Apis mellifera drones during pupal development and sexual maturation, Apidologie 36, 245–254.
Patricio K., Cruz-Landim C. (2002) Mating influence in the ovary differentiation in adult queens of Apis mellifera L. (Hymenoptera, Apidae), Braz. J. Biol. 62, 641–649.
Sauter A., Brown M.J.F., Baer B., Schmid-Hempel P. (2001) Males of social insects can prevent queens from multiple mating, Proc. R. Soc. London B 268, 1449–1454.
Simpson J. (1960) Male genitalia of Apis species, Nature 185, 56.
Snodgrass R.E. (1956) Anatomy of the honeybee, Comstock Publ. Ass. Cornell Univ. Press, Ithaca, N.Y., p. 343.
Strassmann J. (2001) The rarity of multiple mating by females in the social Hymenoptera, Insect. Soc. 48, 1–13.
Tembhare D.B. (2008) Techniques in Life Sciences, Himalaya Publ. House, Mumbai, India.
Tozetto S.D.O., Bitondi M.M.G., Dallacqua R.P., Simões Z.L.P. (2007) Protein profiles of testes, seminal vesicles and accessory gland of honey bee pupae and their relation to the ecdysteroid titer, Apidologie 38, 1–11.
Woyke J. (1956) Anatomo-physiological changes in queen-bees returning from mating flights, and the process of multiple mating, Bull. Acad. Polon. Sci. 4, 81–87.
Woyke J. (1958) The histological structure of the reproductive organs of the drone, Poznan Soc. Friends of Sci., Publ. Sect. Agric. Sylvic. 19, 38–50.
Woyke J., Ruttner F. (1958) An anatomical study of the mating process in the honeybee, Bee World 39, 3–18.
Wyatt G.R., Davey K.G. (1996) An anatomical study of the mating process in the honeybee, Bee World 39, 3–18.
Author information
Authors and Affiliations
Corresponding author
Additional information
Manuscript editor: Klaus Hartfelder
Rights and permissions
About this article
Cite this article
Sawarkar, A.B., Tembhare, D.B. Synthesis and chemical composition of mucus gland secretions in Apis cerana indica . Apidologie 41, 488–496 (2010). https://doi.org/10.1051/apido/2009078
Received:
Revised:
Accepted:
Issue Date:
DOI: https://doi.org/10.1051/apido/2009078