Abstract
Patients with newly diagnosed COVID-19 (coronavirus disease 2019) develop antibodies against SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2). To date, few data have been obtained of the prevalence of SARS-CoV-2-antibodies in general population and in asymptomatic outpatients in Germany.
From March 26 to June 4 2020, 415 asymptomatic outpatients were tested prospectively in Northrhine-Westfalia (Germany), to detect SARS-CoV-2-IgG-antibodies. In case of a positive result, anti-SARS-CoV-2-IgA was determined additionally.
5 of 415 asymptomatic outpatients had positive SARS-CoV-2-IgG-antibodies with a calculated prevalence of 1.2%. Reference range of anti-SARS-CoV-2-IgA and IgG was defined as ratio for negative < 0.8, borderline 0.8—1.1 and > 1.1 positive. The mean concentration of SARS-CoV-2-IgG-antibodies of the positive 5 outpatients was lower than in symptomatic patients with COVID-19 (n = 12) and positive PCR of SARS-CoV-2 (3.04 ± 2.58 versus 8.05 ± 6.70; p = 0.002). 4 of 5 patients had elevated SARS-CoV-2-IgA-antibodies (1.61 ± 0.82). In 408 screening-outpatients with negative anti-SARS-CoV-2-ELISA-IgG (< 0.8), the mean ratio was 0.25 ± 0.13. Two patients were in the borderline range (0.83 and 0.86).
The prevalence of 1.2% of SARS-CoV-2-IgG-antibodies and consequently the rate of infection in asymptomatic outpatients in Northrhine-Westfalia (Germany) is low. The impact of virus neutralisation by antibodies and consequently immunization is the challenge of further investigations.
Similar content being viewed by others

Prof. Dr. med. Burkhard L. Herrmann
Anfang Januar 2020 sequenzierten chinesische Wissenschaftler ein neuartiges Coronavirus, das zur Familie der pleomorphen positiver Einzelstrang RNA-Viren mit Hüllmembran gehört. Es wurde durch die Weltgesundheitsorganisation (WHO) als SARS-CoV-2 (Severe Acute Respiratory Syndrome Coronavirus 2) bekannt. Es verursacht die fulminant verlaufende Pneumonie COVID-19 (Coronavirus Disease 2019) [1, 2]. Die WHO erklärte aufgrund der hohen Kontagiosität und der Schwere der in vielen Fällen tödlich verlaufenden COVID-19 diese Infektionskrankheit zum globalen Notfall [3].
Die Inkubationszeit des SARS-CoV-2 beträgt 3 bis 7 und maximal 14 Tage [4]. Der Nachweis des SARS-CoV-2 erfolgt mittels Reverse-Transkriptase-Polymerase-Kettenreaktion (RT-PCR) überwiegend durch Probengewinnung aus dem naso-oropharyngealen Bereich (Nasen-Rachen-Abstrich) oder durch bronchoalveolärer Lavage, Trachealsekret oder Sputum. 7–10 Tage später lassen sich Antikörper (AK) gegen die S1-Domäne des Spike-Proteins von SARS-CoV-2 nachweisen [5]. Die AK-Bildung scheint bei laboranalytischen positiven Neutralisationstests eine Immunität voraussagen zu können.
Inwiefern sich im Rahmen einer ambulanten Vorstellung (Einzugsgebiet Nordrhein-Westfalen [NRW], Deutschland) SARS-CoV-2-IgG-AK im Screening nachweisen lassen, wurde in einer monozentrischen prospektiven Erhebung an 415 Patienten ohne zurückliegenden wissentlichen Kontakt mit SARS-CoV-2 oder COVID-19 untersucht.
Patientenkollektiv
Vom 26.3.—4.6.2020 wurden 415 Patienten auf SARS-CoV-2-IgG-AK gescreent. Alle Patienten willigten in die Untersuchung ein und gaben an, zum Zeitpunkt der Abnahme unter keinen Symptomen einer akuten Infektion wie Husten, Fieber oder Dyspnoe zu leiden. Alle Patienten wurden durch den Autor eigenständig anamnestiziert und verneinten einen Kontakt mit Menschen, die positiv auf SARS-CoV-2 getestet wurden oder an COVID-19 erkrankt sind.
Methoden
Die SARS-CoV-2-IgG-AK aus Serumproben wurden mit dem ELISA-Test (EI 2606-9601-2 G) von Euroimmun Diagnostik, Lübeck, Deutschland (Anti-SARS-CoV-2-ELISA-IgG) bestimmt [1]. Die verwendeten Reagenzgefäße waren mit einer rekombinanten S1-Domäne des Spike-Proteins von SARS-CoV-2 beschichtet. Das Ergebnis wird semiquantitativ als Ratio angegeben (Ratio = Extinktion der Kontrolle bzw. der Patientenprobe/Extinktion des Kalibrators). Die Referenzbereiche sind wie folgt definiert: negative Ergebnisse ≤ 0,8, Graubereich 0,8–1,1, positiv ≥ 1,1. Bei positivem Nachweis von Anti-SARS-CoV-2-ELISA-IgG wurde zusätzlich der Anti-SARS-CoV-2-ELISA-IgA gemessen (Referenzbereiche wie IgG). Die Sensitivität liegt ≥ 10 Tagen nach Symptombeginn bei 94,4% bei einer Spezifität von 99,6% [5].
Ergebnisse
Bei 5 (Alter 42 ± 27 Jahre; Spannweite [R] 10–78 Jahre) von 415 Patienten ließen sich Anti-SARS-CoV-2-ELISA-IgG nachweisen. Daraus errechnete sich eine Prävalenz von 1,2% in dieser Stichprobe.
Bei 3 von 5 Patienten waren keine Symptome wie Fieber, Husten, Dyspnoe oder Geschmacks-/Geruchsstörungen erinnerlich. Retrospektiv gab ein Patient an, vor 25 Tagen unter Husten und ein Patient vor 50 Tagen unter Husten und Fieber gelitten zu haben. Der durchschnittliche SARS-CoV-2-IgG-AK-Titer der 5 Patienten lag bei 3,04 ± 2,58 (R = 1,11–7,82). 4 von 5 Patienten hatten ebenfalls erhöhte SARS-CoV-2-IgA-AK 1,61 ± 0,82 (R = 0,58–2,93). Bei 408 Patienten, bei denen der Anti-SARS-CoV-2-ELISA-IgG < 0,8 lag, wurde eine durchschnittliche Ratio von 0,25 ± 0,13 (R = 0,09–0,74) ermittelt. Bei 2 von 410 lag der SARS-CoV-2-IgG-AK (0,83 und 0,86) im Graubreich (0,8–1,2). Die SARS-CoV-2-IgA-AK waren mit 0,37 und 0,38 negativ. Beide Patienten wurden als insgesamt negativ klassifiziert.
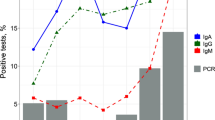
Bei weiteren 12 eingesendeten Proben von Patienten mit COVID-19 und positivem Nachweis von SARS-CoV-2-PCR, die als Vergleichsgruppe dienten, wurden SARS-CoV-2-AK bestimmt, die alle IgG-AK nachwiesen und im Durchschnitt nach 28 ± 10 Tagen einen IgG-Titer von 8,05 ± 6,70 (R = 1,31–24,91) hatten (Abb. 1). Die SARS-CoV-2-IgA-Titer dieser 12 Patienten waren bei 10 von 12 positiv und lagen bei 3,03 ± 1,90 (R = 0,27–6,68).
Diskussion
Die Prävalenz von SARS-CoV-2-IgG-AK mit 1,2% und die damit zu definierende Durchseuchung (1,0 Mio. bei 83,02 Mio. Einwohnern) ist somit niedrig und liegt unterhalb der kalkulierten deutschlandweiten Prävalenz/Infektionsrate von 2,2%, d. h. 1,8 Mio. Einwohnern [6.] Die Dunkelziffer bzw. Durchseuchung scheint somit niedriger als angenommen zu sein. Eine ebenfalls niedrigere Prävalenz wurde auch in einer im Juni 2020 publizierten Studie aus Baden-Württemberg an 4.932 Einwohnern mit einer Rate von 1,3% berechnet [7].
AK-Screening-Untersuchungen lassen epidemiologische Rückschlüsse zu, wenngleich Proben von Blutspendern oder wie im vorliegenden Fall von ambulanten Patienten immer einen statistischen Bias mit sich führen. Stochastische Erhebungen liegen zum jetzigen Zeitpunkt der Pandemie mit SARS-CoV-2 nicht flächendenkend vor. Ein entscheidender Vorteil dieser Erhebung ist, dass alle 415 ambulanten Patienten sehr gut charakterisiert sowie anamnestiziert waren und einen Kontakt mit Menschen, die positiv auf SARS-CoV-2 getestet wurden oder an COVID-19 litten, verneinen konnten.
Die Mehrzahl der Patienten mit positivem Nachweis gaben in der Vergangenheit keine Symptome an. Die SARS-CoV-2-IgG-AK-Titer der Screening-Patienten sind signifikant niedriger als die der SARS-CoV-2-PCR-positiv getesteten Vergleichsgruppe (3,04 ± 2,58 versus 8,05 ± 6,70; p = 0,002).
IgA-AK waren auch bei 80% der Screening-positiven Patienten und bei 83% der PCR-positiven Vergleichsgruppe nachweisbar. Sie eignen sich allerdings nicht als Screening-Parameter, da sich bereits bei 10% der Bevölkerung IgA-AK vor der SARS-CoV-2-Pandemie aufgrund der Kreuzreaktion mit endemischen Coronaviren nachweisen ließen [8, 9].
Für die komplexe Immunantwort, welche sich u. a. durch eine T-Zell-vermittelte Reaktion und durch AK-Produktion charakterisiert, ist auch die sekretorische IgA-Konzentration evident. Messungen der sekretorischen IgA in Tränenflüssigkeiten lassen eine primäre Immunabwehr vermuten. Bei einem schweren Verlauf der COVID-19-Erkrankung entwickelt sich eine Lympho- und Eosinophilie, die den Verbrauch der AK widerspiegelt und das Krankheitsbild durch Entwicklung einer fulminanten Pneumonie mit einem ARDS (Acute Respiratory Distress Syndrome) sowie einem möglichen Multiorganversagens aggraviert [10].
Zum jetzigen Zeitpunkt scheinen asymptomatische Verläufe gegenüber den symptomatischen deutlich zu überwiegen [11]. Nach einer aktuellen Studie wird die SARS-CoV-2-AK-Bildung, z. B. bei medizinischem Personal, ebenfalls überschätzt [12].
20% der COVID-19-Patienten müssen stationär behandelt werden. Die CFR (Case Fatality Rate) lag am 15. Juni 2020 in Deutschland bei 4,69% und liegt unterhalb der weltweiten Rate von 5,46%.
Inwiefern der positive Nachweis von SARS-CoV-2-IgG-AK eine Immunität induziert und ob sich Unterschiede der Titer ergeben, ist im weiteren Verlauf der Corona-Pandemie zu evaluieren. Aktuell kann nicht zwangsläufig von einer Immunität bei nachweisbaren AK von asymptomatischen oder symptomatischen Patienten ausgegangen werden [13].
Literatur
Coronaviridae Study Group of the International Committee on Taxonomy of V. The species Severe acute respiratory syndromerelated coronavirus: classifying 2019-nCoV and naming it SARSCoV-2. Nat Microbiol. 2020;5(4):536–544
Zhu N, Zhang D, Wang W, et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N Engl J Med. 2020;382(8):727–733
(WHO) WHO. Coronavirus disease (COVID-2019) situation reports. https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports
Wang G, Jin X. The Progress of 2019 Novel Coronavirus (2019- nCoV) event in China. J Med. Virol. Doi: https://doi.org/10.1002/jmv25705
Okba NMA et al. SARS-CoV-2 specifc antibody responses in COVID-19 patients. Preprint medRxiv: 5/2020 https://doi.org/10.1101/2020.03.18.20038059
Streeck, H et al.: Infection fatality rate of SARS-CoV-2 infection in a German community with a super-spreading event. 5/2020 Preprint medRxiv: https://doi.org/10.1101/2020.05.04.20090076
Debatin KM et al. Prevalence of COVID-19 in children in BadenWürttemberg Preliminary study report 6/2020: https://www.klinikum.uniheidelberg.de/fleadmin/pressestelle/Kinderstudie/Prevalence_of_COVID-19_in_BaWu__.pdf
Antibody tests suggest that coronavirus infections vastly exceed ofcial counts. Nature News 22 April 2020. https://www.nature.com/articles/d41586-020-01095-0
Antibody surveys suggesting vast undercount of coronavirus infections may be unreliable. Sciene 21 April 2020. https://www.sciencemag.org/news/2020/04/antibody-surveys-suggestingvast-undercount-coronavirus-infections-may-be-unreliable
Azkur AK et al., Immune response to SARS-CoV-2 and mechanisms of immunopathological changes in COVID-19. 2020 https://doi.org/10.1111/ALL.14364
Bai Y, Yao L, Wei T, et al. Presumed Asymptomatic Carrier Transmission of COVID-19. JAMA. 2020.
Behrens GMN et al., Perceived versus proven SARS CoV 2 specifc immune responses in health care professionals: Infection. 2020 Jun 10: 1–4. doi: https://doi.org/10.1007/s15010-020-01461-0
EUnetHTA Joint Action 3 WP4. Rapid collaborative review on the current role of antibody tests for novel coronavirus SARS-CoV-2 in the management of the pandemic. Project ID: RCR OT 01, Version 1.2., 22. June 2020
Author information
Authors and Affiliations
Corresponding author
Additional information
Interessenkonflikt
Der Autor hat Vortragshonorare von Amgen, Boehringer Ingelheim, Diagnosticum Dresden und Sanofi erhalten.
Rights and permissions
About this article
Cite this article
Herrmann, B.L. Die Prävalenz von SARS-CoV-2-IgG-AK liegt bei 1,2%. MMW - Fortschritte der Medizin 162, 44–46 (2020). https://doi.org/10.1007/s15006-020-0750-y
Published:
Issue Date:
DOI: https://doi.org/10.1007/s15006-020-0750-y