Background and Purpose:
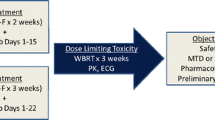
Topotecan penetrates the blood-brain barrier and sensitizes tumor cells against radiation. A phase I/II dose-escalating trial of repetitive daily i. v. topotecan application simultaneously with whole-brain irradiation (WBRT) was conducted to estimate toxicity, maximum tolerated dose and survival in patients with inoperable brain metastases.
Patients and Methods:
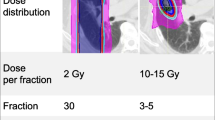
In 47 patients suffering from previously untreated brain metastases, topotecan was applied on a daily i. v. schedule simultaneously with WBRT (36 Gy/3-Gy fractions). The infusion schedule started at the beginning of WBRT and was discontinued during weekends. Each infusion was completed within 1–2 h before irradiation. In a dose-finding study, topotecan was escalated from 5 × 0.5 mg/m2, 8 × 0.5 mg/m2, 12 × 0.5 mg/m2 to 12 × 0.6 mg/m2.
Results:
Altogether, 38/47 patients (81%) completed the prescribed schedule. Leukopenia and thrombocytopenia were dose-limiting. Grade 3/4 hematologic toxicity occurred in 5/32 chemonaive patients (16%) and 7/15 patients (47%) with previous chemotherapy. At 12 × 0.6 mg/m2, 2/4 patients experienced grade 4 leukopenia/thrombopenia. Nonhematologic toxicities were generally mild to moderate and unrelated to topotecan. Response evaluation was possible in 26/47 patients, overall response rate was 58% (CR [complete remission] 5/26, PR [partial remission] 10/26, NC [no change] 8/26). Median survival amounted to 5.1 months. In 15/42 patients (36%), brain metastases were the dominant cause of death.
Conclusion:
For a daily topotecan schedule simultaneous to WBRT, the maximum tolerated dose is 12 × 0.5 mg/m2 in chemonaive patients. For chemo-pretreated patients, daily doses should be reduced to 0.4 mg/m2. A phase III trial has now been started to find out whether WBRT + topotecan increases survival compared to WBRT alone.
Hintergrund und Ziel:
Topotecan, ein Topoisomeraseinhibitor, gehört zu den wenigen Substanzen, die die Blut-Hirn-Schranke durchdringen und Tumorzellen gegenüber ionisierender Strahlung sensibilisieren. Daher wurde eine Phase-I/II-Studie zur kombinierten Radiochemotherapie bei Patienten mit inoperablen Hirnmetastasen durchgeführt. Untersucht wurden Toxizität, maximal tolerable Dosis, Ansprechen der Hirnmetastasen und Überlebenszeit.
Patienten und Methodik:
Bei 47 Patienten mit unvorbehandelten Hirnmetastasen wurde eine palliative Ganzhirnbestrahlung mit 36 Gy/3 Gy mit einer täglichen Kurzinfusion von Topotecan 1–2 h vor der Bestrahlung kombiniert. Die erste Topotecaninfusion erfolgte am 1. Bestrahlungstag; an den Wochenenden wurden Bestrahlung und Topotecan ausgesetzt. Die Topotecandosis wurde wie folgt eskaliert: 5 × 0,5 mg/m2, 8 × 0,5 mg/m2, 12 × 0,5 mg/m2, 12 × 0,6 mg/m2.
Ergebnisse:
Insgesamt konnte bei 38/47 Patienten (81%) die Therapie wie vorgesehen durchgeführt werden. Dosislimitierend für die Topotecan-Chemotherapie waren Leukopenie und Thrombopenie. Eine Hämatotoxizität Grad 3/4 trat bei 5/32 chemotherapeutisch unvorbehandelten Patienten (16%) und bei 7/15 Patienten (47%) auf, die bereits zuvor eine Chemotherapie erhalten hatten. Unter einer Dosis von 12 × 0,6 mg/m2 kam es bei 2/4 Patienten zu einer Leukopenie/Thrombopenie Grad 4. Nichthämatologische Toxizitäten waren gering bis mäßig ausgeprägt und meist nicht durch Topotecan bedingt. Bei 26/47 Patienten konnte das Ansprechen beurteilt werden; die Ansprechrate lag bei 58% (CR [komplette Remission] 5/26, PR [partielle Remission] 10/26, NC [stabile Erkrankung] 8/26). Die mediane Überlebenszeit betrug 5,1 Monate. Bei 15/42 Patienten (36%) waren zerebrale Metastasen die Todesursache.
Schlussfolgerung:
Bei simultaner, täglicher Applikation von Topotecan beträgt die maximal tolerable Dosis für nicht chemotherapeutisch vorbehandelte Patienten 12 × 0,5 mg/m2. Für chemotherapeutisch vorbehandelte Patienten sollte die tägliche Dosis auf 0,4 mg/m2 reduziert werden. Ob sich durch die Kombination mit Topotecan im Vergleich zu einer alleinigen Ganzhirnbestrahlung das Überleben verbessern lässt, wird jetzt in einer Phase-III-Studie untersucht.
Similar content being viewed by others
Author information
Authors and Affiliations
Corresponding author
Rights and permissions
About this article
Cite this article
Kocher, M., Eich, HT., Semrau, R. et al. Phase I/II Trial of Simultaneous Whole-Brain Irradiation and Dose-Escalating Topotecan for Brain Metastases. Strahlenther Onkol 181, 20–25 (2005). https://doi.org/10.1007/s00066-005-1242-9
Received:
Accepted:
Issue Date:
DOI: https://doi.org/10.1007/s00066-005-1242-9
Key Words:
- Brain metastases
- Whole-brain radiotherapy
- Combined radiochemotherapy
- Topoisomerase I inhibitor
- Topotecan