Abstract
Severe combined immune deficiency (SCID) mice have been used as an animal model to study both the direct cytopathic effect of enteroviruses on the heart in the absence of an effective immune system and to investigate the role of immune mediated processes in the pathogenesis of human myocarditis.
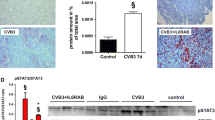
The infection of SCID mice with coxsackievirus B3 resulted in severe myocarditis with very high titers of the virus in the myocardium and severe necrosis of myocytes. This direct cytopathic effect caused an impairment of the myocardial function and resulted in a high mortality rate of the infected animals.
For the study of the immune mechanisms in human myocarditis, peripheral blood leukocytes of patients with myocarditis, having an impaired left ventricular function without viral persistence in the myocardium, were transferred into SCID mice. As controls peripherals blood leukocytes of normal donors were used. At 60 days after transfer, human immunoglobulines could be demonstrated in the peripheral blood of the SCID mice, however, human autoantibodies against the adenine nucleotide translocator, a myocardial autoantigen, were only present in the animals receiving peripheral blood leukocytes from patients with myocarditis. Cellular infiltrates of human leukocytes in the myocardium and an impaired left ventricular function were also only observed in animals reconstituted with peripheral blood leukocytes from patients. These effects were T cell dependent as shown by differential transfer.
These results are of interest for the treatment of human myocarditis, suggesting the avoidance of an immunosuppressive therapy in acute or chronic myocarditis with viral persistence to prevent a direct cytophatic effect in the absence of an effective immune system. However, in the setting of a chronic, (auto-)immunological myocarditis with the proven absence of entero- or adneoviral sequences an immunomodulatory therapy seems to be effective and safe.
Zusammenfassung
Die Bedeutung einer enteroviralen Infektion sowie einer resultierenden Immunreaktion ist immer noch Gegenstand der Forschung in der Pathogenese der humanen Myokarditis. Mäuse mit einer kombinierten Immundefizienz (“severe combined immundeficiency”, SCID-Mäuse), die keinen eigenen funktionstüchtigen peripheren B- und T-Lymphozyten besitzen, wurden im Tiermodell verwendet, um den direkten zytopathischen Effekt von Enteroviren auf Herzmuskelzellen in der Abwesenheit eines effektiven Immunsystems zu untersuchen. Außerdem kann dieses Tiermodell verwendet werden, um die Rolle von immunologischen und autoimmunologischen Prozessen in der Pathogenese der humanen Myokarditis zu analysieren.
Die Infektion von SCID-Mäusen mit Coxsackie-B3-Viren führt zu einer ausgeprägten Myokarditis bei sehr hohen Virustitern im Myokardgewebe und schweren Myokardzellnekrosen. Dieser direkte zytopathische Effekt verursacht eine Einschränkung der myokardialen Pumpfunktion und führte zu einer hohen Mortalitätsrate in den infizierten Tieren, während immunkompetente Mäuse praktisch keine Mortalität aufweisen.
Zur Untersuchung der Immunmechanismen bei der humanen Myokarditis wurden periphere Blutleukozyten von Patienten mit Myokarditis, die eine eingeschränkte linksventrikuläre Funktion, jedoch keine Viruspersistenz im Myokard aufwiesen, auf SCID-Mäuse übertragen. Als Kontrollen dienten die peripheren Blutleukozyten von gesunden Personen. 60 Tage nach dem Transfer fanden sich humane Immungloboline im peripheren Blut der SCID-Mäuse. Humane Autoantikörper gegen den Adenin-Nukleotid-Translokator, ein myokardiales Autoantigen, fanden sich hingegen nur bei den Tieren, die periphere Blutleukozyten von Patienten mit Myokarditis erhalten hatten. Zelluläre Infiltrate von humanen Leukozyten im Myokard und eine Einschränkung der linksventrikulären Funktion (verminderte Druckanstiegsgeschwindigkeit) lagen ebenso nur bei den SCID-Mäusen vor, die periphere Blutleukozyten von Patienten mit Myokarditis erhalten hatten. Die Tiere wiesen jedoch keinen Anhalt für eine Graft-versus-Host-Reaktion auf, wie die Untersuchung von verschiedenen anderen Geweben ergab. Der Transfer der humanen Myokarditis in SCID-Mäusen ist ein T-Zell-abhängiger Prozess, wie ein entsprechender differenzieller Transfer von nur CD4-positiven oder CD4-depletierten peripheren Blutleukozyten zeigte.
Diese Untersuchungen dürften für die Therapie der humanen Myokarditis von Bedeutung sein. Diese Experimente legen nahe, dass im Rahmen der Myokarditis des Menschen vor allem im Stadium der akuten Erkrankung auf eine immunsuppressive Therapie verzichtet werden sollte, um eine Schwächung des Immunsystems und damit eine erhöhte Virämie und somit auch eine Verstärkung des direkten zytopathischen Effektes auf die Herzmuskelzellen zu verhindern. Aber auch im chronischen Stadium der Erkrankung sollte eine Viruspersistenz durch Entnahme von Myokardbiopsien mit entsprechender molekularbiologischer Analyse (Polymerasekettenreaktion und/oder In-situ-Hybridisierung für Entero- bzw. Adenoviren) untersucht werden, bevor eine immunsuppressive Therapie erwogen wird. In diesem Stadium der Erkrankung sollte bei nachgewiesener Viruspersistenz vielmehr möglicherweise eine Therapie mit subkutanen Gaben von Interferon initiiert werden, wie Untersuchungen unserer eigenen Arbeitsgruppe zwischenzeitlich nahelegen.
Zum anderen sprechen die Befunde dieses Tiermodells auch dafür, dass es sich bei der Myokarditis des Menschen im chronischen Stadium der Erkrankung bei Ausschluss einer Viruspersistenz um einen chronischen autoimmunologischen Prozess handelt, der einer immunmodulatorischen Therapie zugeführt werden sollte. Nur durch eine differenzierte histologische, immunhistologische und molekularbiologische Diagnostik ist es jedoch möglich, eine Differenzierung des akuten virologischen Stadiums der Erkrankung von einem chronischen, immunologisch bedingten Stadium vorzunehmen und dementsprechend eine sinnvolle kausale Therapie durchzuführen.
Similar content being viewed by others
Author information
Authors and Affiliations
Additional information
Rights and permissions
About this article
Cite this article
Schwimmbeck, P., Rohn, G., Wrusch, A. et al. Enteroviral and Immune Mediated Myocarditis in SCID mice. Herz 25, 240–244 (2000). https://doi.org/10.1007/s000590050013
Issue Date:
DOI: https://doi.org/10.1007/s000590050013