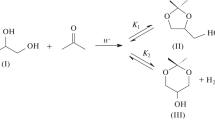
Abstract
The reaction of 2-methyl pent-2-ene with primary alcohols (C1-C18) at 95°C over an Al-montmorillonite gave yields of 20–90% of ethers of the type R-O-C(CH3)2C3H7. Lower yields were produced if secondary alcohols were employed, and tertiary alcohols gave only a trace of this ether. When a variety of alkenes was reacted with butan-1-ol at 95°C over a similar catalyst, no reaction occurred unless the alkene was capable of forming a tertiary carbonium ion immediately upon protonation. In this case the product was the tertiary ether t-R-O-nC4H9. However, at a reaction temperature of 150°C a variety of products were formed including (1) ether by the attack of butanol on the carbonium ions produced either directly from protonation of the alkenes or by hydride shift from such an ion, (2) alkenes by the attack of n-C4H9+ ions (derived from protonation and dehydration of butanol) on the alkene, (3) di-(but-1-yl) ether by dehydration of the butanol, and (4) small amounts of alcohol by hydration of the alkene. The differences in reactivity below and above 100°C are related directly to the amount of water present in the interlayer space of the clay and the degree of acidity found there. Although the clay behaves as an acid catalyst, the reactions are far cleaner (more selective) than comparable reactions catalyzed by sulfuric acid.
Резюме
Реакция 2-метил пент-2-ена с первичными спиртами (С1-С18) при температуре 95°С в присутствии Аl-монтмориллонита приводила к образованию 20–90% эфиров типа R-O-С(СН3)2С3Н7. Меньшие количества производились при использовании вторичных спиртов, в то время как третичные спирты давали только следы этого эфира. Когда разные алкены реагировали с бутан-1-олем при 95°С в присутствии подобного катализатора, реакции не происходили до тех пор, пока алкен не был способен образовать третичного карбониевого иона немедленно после протонирования. В этом случае продуктам являлся третичный эфир t-R-O-nС4Н9. Однако, при температуре реакции 150°С образовывались разные продукты, включаж (1) эфир, полученный воздействием бутаноля на карбониевые ионы, произведенные либо непосредственно путем протонирования алкенов, либо путем сдвига гидрида из этого иона, (2) алкены, полученные воздействием ионов n-С4Н9+ (полученных путем протонирования и дегидратации бутаноля) на алкен, (3) ди-(бут-1-ил) эфир путем дегидратации бутаноля и (4) небольшие количества спирта путем гидратацйй алкена. Различные значения реактивности ниже и выше 100°С связаны непосредственно с количеством воды, присутствующей в прослойках глины, и степенью кислотности. Хотя глина ведет себя как кислотный катализатор, реакции являются на много чище (более селективными), чем соответствующие реакции, катализированные серной кислотой. [Е.С.]
Resümee
Die Reaktion von 2-methyl-pent-2-en mit primären Alkoholen (C1–C18) bei 95°C über einem Al-Montmorillonit ergab 20–90% Ather des Typs R-O-C(CH3)2C3H7. Geringere Ausbeuten wurden erreicht, wenn sekundäre Alkohole eingesetzt wurden. Tertiäre Alkohole ergaben nur Spuren dieses Äthers. Wenn unterschiedliche Alkene mit Butan-l-ol bei 95°C über einem ähnlichen Katalysator zur Reaktion gebracht wurden, trat keine Reaktion ein. außer das Alken war in der Lage, ein tertiäres Carbonium-Ion unmittelbar nach der Protonierung zu bilden. In diesem Fall war das Produkt ein tertiärer Äther t-R-O-nC4H9. Bei einer Reaktionstemperatur von 150°C wurde jedoch eine Vielzahl von Produkten gebildet einschließlich (1) Äther, unter der Einwirkung von Butanol auf die Carbonium-Ionen, entweder direkt bei der Protonierung von Alkenen oder durch Hydridverschiebung von diesen Ionen, (2) Alkene. unter der Einwirkung von n-C4H9+ -Ionen (gebildet bei der Protonierung und Dehydrierung von Butanol) auf das Alken. (3) Di-(but-1-yl)-Äther, durch Dehydrierung von Butanol und (4) geringe Mengen von Alkohol, durch die Hydrierung von Alken. Die Unterschiede in der Reaktivität unter und über 100°C hängen direkt mit der Wassermenge zusammen, die in den Zwischenschichten des Tons vorhanden ist und mit der dort herrschenden Acidität. Obwohl der Ton als ein saurer Katalysator wirkt, sind die Reaktionen viel sauberer (selektiver) als vergleichbare Reaktionen, die durch Schwefelsäure katalysiert werden. [U.W.]
Résumé
La réaction de pent-2-ène méthyl-2 avec des alcohols primaires (C1–C18) à 95°C sur une montmorillonite-Al a fourni de 20–90% d’éthers du type R-O-C(CH3)2C3H7. Des rendements moindres étaient produits lorsque des alcohols secondaires étaient employés, et des alcohols tertiaires n’ont produit qu’ une trace de cet éther. Lorsqu’ on a fait réagir une variété d’alkènes avec du butan-1-ol à 95°C sur un catalyste similaire, ancune réaction ne se produisait à moins que l’alkène n’était capable de former un ion carbonium tertiaire dés que se passait la protonation. Dans ce cas, le produit était l’éther tertiaire t-R-O-nC4H9. A une température de réaction de 150°C cependant, une variété de produits on été formés, comprenant (1) un éther par l’attaque du butanol sur les ions carbonium produits soit directement par la protonation des alkènes soit par déplacement hydride d’un tel ion, (2) des alkènes par l’attaque des ions n-C4H9+ (derivés de la protonation et la déshydration du butanol) sur l’alkène, (3) l’éther di-but-1-yl) par la déshydration du butanol, et (4) de petites quantités d’alcohol par hydration de l’alkène. Les différences de réactivité au dessus et dessous 100°C sont directement apparentées à la quantité d’eau présente dans l’espace interfeuillet de l’argile et au degré d’acidité trouvé là. Quoique l’argile se comporte comme un catalyste acide, les réactions sont beaucoup plus propres (plus sélectives) que des réactions comparables catalysées par un acide sulphurique. [D.J.]
Similar content being viewed by others
References
Adams, J. M., Ballantine, J. A., Graham, S. H., Laub, R. J., Purnell, J. H., Reid, P. I., Shaman, W. Y. M., and Thomas, J. M. (1979a) Selective chemical conversions using sheet silicates: low temperature addition of water to 1-alkenes: J. Catal. 58, 238–252.
Adams, J. M., Bylina, A., and Graham, S. H. (1982a) Shape selectivity in low temperature reactions of C6 alkenes catalyzed by a Cu2+-exchanged montmorillonite: Clay Miner. 16, 325–332.
Adams, J. M., Clement, D. E., and Graham, S. H. (1981) Low temperature reaction of alcohols to form t-butyl ethers using clay catalysts: J. Chem. Res., S254–S255.
Adams, J. M., Clement, D. E., and Graham, S. H. (1982b) Synthesis of methyl t-butyl ether (MTBE) from methanol and isobutene using a clay catalyst: Clays & Clay Minerals 30, 129–132.
Adams, J. M., Davies, S. E., Graham, S. H., and Thomas, J. M. (1978) Ready production of benzophenone from diphenylethylene catalyzed by a synthetic hectorite: J. Chem. Soc. Chem. Comm., 930–931.
Adams, J. M., Davies, S. E., Graham, S. H., and Thomas, J. M. (1979b) Hydrogen exchange between 9,10-dihydroanthracene and 1,1-diphenylethylene over a synthetic hectorite: J. Chem. Soc. Chem. Comm., 527–528.
Ballantine, J. A., Davies, M., Purnell, J. A., Rayanakorn, M., Thomas, J. M., and Williams, K. J. (1981a) Chemical conversions using sheet silicates: facile ester synthesis by direct addition of acids to alkenes: J. Chem. Soc. Chem. Comm., 8–9.
Ballantine, J. A., Davies, M., Purnell, J. H., Rayanakorn, M., Thomas, J. M., and Williams, K. J. (1981b) Chemical conversions using sheet silicates: novel intermolecular dehydration of alcohols to ethers and polymers: J, Chem. Soc. Chem. Comm., 427–428.
Bittles, J. A., Chaudhuri, A. K., and Benson, S. W. (1964a) Clay-catalyzed reactions of olefins. I. Polymerization of styrene: J. Polym. Sci. Part A, 2, 1221–1231.
Bittles, J. A., Chaudhuri, A. K., and Benson, S. W. (1964b) Clay-catalyzed reactions of olefins. II. Catalyst acidity and mechanism: J. Polym. Sci. Part A, 2, 1847–1862.
Bittles, J. A., Chaudhuri, A. K., and Benson, S. W. (1963c) Clay-catalyzed reactions of olefins. III. Kinetics of polymerization of styrene: J. Polym. Sci. Part A, 2, 3023–3032.
Bylina, A., Adams, J. M., Graham, S. H., and Thomas, J. M. (1980) Chemical conversions using sheet silicates: a simple method for producing methyl t-butyl ether (MTBE): J. Chem. Soc. Chem. Comm., 1003–1004.
Fieser, L. F. and Fieser, M. (1961) Advanced Organic Chemistry: Reinhold, New York, 285–287.
Fripiat, J. J. and Cruz-Cumplido, M. I. (1974) Clays as catalysts for natural processes: Annu. Rev. Earth Planet. Sci. 2, 239–256.
Fripiat, J. J., Jelli, A., Poncelet, G., and Andre, J. (1965) Thermodynamic properties of adsorbed water molecules and electrical conduction in montmorillonites and silicas: J. Phys. Chem. 69, 2185–2197.
Hougardy, J., Stone, W. E. E., and Fripiat, J. J. (1976) NMR study of adsorbed water. I. Molecular orientation and protonic motions in the two layer hydrate of sodium vermiculite: J. Chem. Phys. 64, 3840–3851.
Mortland, M. M. (1968) Protonation of compounds at clay mineral surfaces: Trans. 9th Int. Cong. Soil Sci., J. W. Holmes, ed., Elsevier, New York, 691–699.
Mortland, M. M., Fripiat, J. J., Chaussidon, J., and Uytterhoeven, J. (1963) Interaction between ammonia and the expanding lattices of montmorillonite and vermiculite: J. Phys. Chem. 67, 248–258.
Mortland, M. M. and Mellor, J. L. (1954) Conductometric titration of soils for cation exchange capacity: Soil Sci. Soc. Amer. Proc. 18, p. 363.
Theng, B. K. G. (1974) The Chemistry of Clay-Organic Reactions: Adam Hilger, London, 261–292.
Thomas, J. M., Adams, J. M., Graham, S. H., and Tennakoon, D. T. B. (1977) Chemical conversion using sheet silicate intercalates: In Solid State Chemistry of Energy Conversion and Storage, J. B. Goodenough and M. S. Whittingham, eds., ACS Advances in Chemistry Series 163, Amer. Chem. Soc, Washington, D.C., 298–315.
Touillaux, R., Salvador, P., Vandermeersche, C, and Fripiat, J. J. (1968) Study of water layers adsorbed on sodium and calcium montmorillonite by the pulsed nuclear magnetic resonance technique: Israel J. Chem. 6, 337–348.
Author information
Authors and Affiliations
Additional information
Deceased.
Rights and permissions
About this article
Cite this article
Adams, J.M., Clement, D.E. & Graham, S.H. Reactions of Alcohols with Alkenes over an Aluminum-Exchanged Montmorillonite. Clays Clay Miner. 31, 129–136 (1983). https://doi.org/10.1346/CCMN.1983.0310207
Received:
Accepted:
Published:
Issue Date:
DOI: https://doi.org/10.1346/CCMN.1983.0310207