Abstract
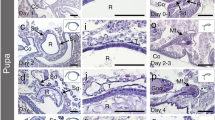
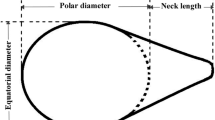
In this work, we examined the effect of delayed mating on spermathecal development in Melipona quadrifasciata anthidioides queens. The histology and histochemistry of the spermatheca of virgin queens zero, 15, 20, and 30 days old and physogastric queens were compared. There were no significant differences in the thickness of the epithelium and the volume of the spermathecal reservoir among virgin queens of different ages. However, physogastric queens had more voluminous spermathecae and thinner epithelia than virgin queens. The structure of the spermathecal glands was also influenced by mating. These findings suggest that mating leads to activation of the spermatheca and its glands.
Zusammenfassung
Die Erhaltung der Lebensfähigkeit der Spermatozoen ist ein kritischer Aspekt einer erfolgreichen Reproduktion und insbesondere bei sozialen Bienen ist dies über einen langen Zeitraum hin erforderlich. Die Spermatheka ist eine spezifische Struktur im weiblichen Reproduktionstrakt, die genau diese Funktion erfüllt. Da bei frischgeschlüpften Königinnen die Spermatheka noch nicht voll entwickelt ist, war es das Ziel dieser Studie die Auswirkung einer Verzögerung in der Paarung auf die Entwicklung der Spermatheka und ihrer Drüsen bei der Stachellosen Biene Melipona quadrifasciata anthidioides zu untersuchen. Dazu verglichen wir die Spermatheken von nicht verpaarten 0, 15, 20 und 30 Tage alten Jungköniginnen mit denen von physogastrischen Königinnen hinsichtlich ihrer Histologie und histochemischer Parameter. Bei den unverpaarten Jungköniginnen verschiedenen Alters fanden wir keine signifikanten Unterschiede in der Epitheldicke und dem Innenvolumen der Spermatheka. Physogastrische Königinnen hingegen hatten wesentlich voluminösere Spermatheken mit dickeren Epithelien. Auch auf die Spermathekaldrüsen hatte die Paarung offensichtlich eine deutliche Wirkung. Bei frischgeschlüpften Jungköniginnen war der Polysaccharidgehalt zunächst noch relativ hoch und während bei 30 Tage alten Jungköniginnen nur noch ein geringer Polysaccharidgehalt zu verzeichnen war, zeigten physogastrische Königinnen bereits wieder einen deutlich erhöhten Polysaccharidgehalt in ihren Spermathekaldrüsen. Das Spermathekenepithel sowohl von Jungköniginnen als auch von physogastrischen Königinnen zeigte positive Reaktionen in Proteintests. Ausserdem fanden wir Proteingranula in den Drüsen von physogastrischen Königinnen. Diese Ergebnisse lassen den Schluss zu, dass der Paarungsprozess die Spermathekenentwicklung und die Aktivität der Spermathekaldrüsen in positiver Weise beeinflusst. Eine Verzögerung in der Paarung zeigte hingegen keine negativen Auswirkungen auf die Spermatheka von Jungköniginnen.
Similar content being viewed by others
References
Bhatnagar R.D.S., Musgrave A.J. (1971) Aspects of histophysiology of the spermathecal gland of Sitophilus granarius (L.) (Coleoptera), Can. J. Zool. 49, 275–277.
Camargo J.M.F., Mello M.L. (1970) Anatomy and histology of the genital tract, spermatheca, spermathecal duct and glands of Apis mellifera queens (Hymenoptera: Apidae), Apidologie 1, 351–373.
Chapman R.F. (1998) The Insects: Structure and Function, American Elsevier Publishing Company, New York.
Clements A.N., Potter S.A. (1967) The fine structure of the spermatheca and their ducts in the mosquito Aedes aegypti, J. Insect Physiol. 13, 1825–1836.
Coggeshall E.R. (1992) A consideration of neural counting methods, Trends Neurosci. 15, 9–13.
Cruz-Landim C., Serrão J.E. (2002) Ultrastructure of the spermathecal gland of Melipona bicolor Lep. (Hymenoptera, Apinae, Meliponini), Braz. J. Morphol. Sci. 19, 9–16.
Cruz-Landim C., Yabuki A.T., Iamonte M. (2003) Ultrastructure of the spermatheca of Melipona bicolor bicolor Lep. (Hymenoptera, Apinae, Meliponini), Bioscience J. 19, 57–64.
Dallai R. (1972) Fine structure of the spermathecal gland of Apis mellifera, Redia 53, 413–425.
Dallai R. (1975) Fine structure of the spermatheca of Apis mellifera, J. Insect Physiol. 21, 89–109.
Davey K.G., Webster G.F. (1967) The structure and secretion of the spermatheca of Rhodnius prolixus Stal: A histochemical study, Can. J. Zool. 45, 653–657.
Hitchcock J.D. (1956) Honey bee queens whose eggs all fail to hatch. J. Econ. Entomol. 49, 11–14.
Klenk M., Koeniger G., Koeniger N., Fasold H. (2004) Proteins in spermathecal gland secretion and spermathecal fluid and the properties of a 29 kDa protein in queens of Apis mellifera, Apidologie 35, 371–381.
Kressin M., Sommer U., Schnorr B. (1996) The spermathecal epithelium of the queen bee (Apis mellifera): Morphology, age-dependent changes and cell contacts, Anat. Histol. Embryol. 1, 31–35.
Laidlaw Jr H.H. (1944) Artificial insemination of the queen bee (Apis mellifera L.): Morphological basis and results, J. Morphol. 74, 429–465.
Lensky Y., Schindler H. (1967) Motility and reversible inactivation of honeybee spermatozoa in vivo and in vitro, Ann. Abeille 10, 5–16.
Martins G.F., Serrão J.E. (2002) A comparative study of the spermathecae in bees (Hymenoptera; Apoidea), Sociobiology 40, 711–720.
Noirot C., Quennedey A. (1991) Glands, gland cell, glandular units: some comments on terminology and classification, Ann. Soc. Entomol. Fr. 27, 123–128.
Pabalan N., Davey K.G., Packer L. (1996) Comparative morphology of spermathecae in solitary and primitively eusocial bees (Hymenoptera; Apoidea), Can. J. Zool. 74, 802–808.
Pearse A.G.E. (1985) Histochemistry: Theoretical and Applied, Churchill, London.
Poole H.K. (1970) The wall structure of the honey bee spermatheca with comments about its function, Ann. Entomol. Soc. Am. 63, 1625–1628.
Schoeters E., Billen J. (2000) The importance of the spermathecal duct in bumblebees, J. Insect Physiol. 46, 1303–1312.
Snodgrass R.E. (1933) Morphology of the insect abdomen, Pt. II. The genitals ducts and the ovipositor, Smithsonian Misc. Coll. 89, 1–148.
Snodgrass R.E. (1935) Principles of insect morphology, McGraw-Hill, New York.
Snodgrass R.E. (1956) Anatomy of honey bee, Comstock Publish Company, Ithaca.
Stefanini M., Demartino C., Zamboni L. (1967) Fixation of ejaculated spermatozoa for electron microscopy, Nature 216, 173–174.
Taber S., Blum M.S. (1960) Preservation of honey bee semen, Science 131, 1734–1735.
Thornhill R., Alcock J. (1983) The Evolution of Insect Mating Systems, Harvard University Press, Cambridge.
Author information
Authors and Affiliations
Corresponding author
Additional information
Manuscript editor: Klaus Hartfelder
Rights and permissions
About this article
Cite this article
Souza, E.A., Campos, L.A.O., Neves, C.A. et al. Effect of delayed mating on spermathecal activation in Melipona quadrifasciata anthidioides (Hymenoptera, Apidae) queens. Apidologie 39, 293–301 (2008). https://doi.org/10.1051/apido:2008008
Received:
Revised:
Accepted:
Issue Date:
DOI: https://doi.org/10.1051/apido:2008008