Abstract
Although the alien Impatiens glandulifera successfully invades riparian habitats and is visited by native insects, knowledge of its impact on native bees is limited. We assessed pollinator abundance in field sites where I. glandulifera was absent, present or had been experimentally removed. We measured insect visitation to flowers of potted native plants and to I. glandulifera. Bombus spp. comprised the highest proportion of visitors in invaded sites, whereas solitary bees made up the highest proportion in sites where I. glandulifera was removed. More bees, especially medium- and long-tongued Bombus spp. (B. pascuorum and B. hortorum), foraged on I. glandulifera than the native plant species (possibly because the alien was more abundant). We detected no impact of invasion on standardised pollinator abundance, B. pascuorum abundance, nor functional insect diversity, which may be due to variable climatic conditions. We suggest that future studies focus on impacts on rare or specialised pollinator taxa.
Zusammenfassung
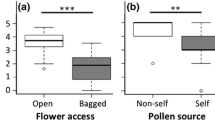
Die Kenntnis über die Auswirkungen von Neophyten auf die einheimischen bestäubenden Insekten ist äußerst gering. Einige invasive Pflanzen haben auffällige florale Kennzeichen, eine hohe Nektarsekretion und sind daher attraktiv für einheimische Insekten. Eine dieser Arten ist Impatiens glandulifera, die sich erfolgreich in Flussauen von ganz Europa verbreitet hat und deren Effekte auf die einheimische Flora recht gut untersucht sind. Wir wissen allerdings wenig über direkte oder indirekte Auswirkungen von I. glandulifera auf einheimische Bestäuber. Wir erfassten die Abundanz von Bestäubern in Untersuchungsgebieten, in denen I. glandulifera vorkam bzw. nicht vorkam und in Gebieten, in denen I. glandulifera experimentell entfernt wurde. An jedem Standort legten wir nach einem standardisierten Muster Pflanzengesellschaften aus drei einheimischen Arten an und erfassten die Insektenbesuche an diesen Pflanzen. Zusätzlich erfassten wir die Besuche an I. glandulifera und führten Experimente zur Wiederfindung markierter Bombus pascuorum durch, um die Nutzung der Standorte durch Hummeln zu beurteilen. Die Anwesenheit und/oder die Entfernung von I. glandulifera hatte weder auf die standardisierte Abundanz von Insekten noch auf die funktionelle Insektendiversität einen signifikanten Einfluss (Tab. I), was eventuell auf die unterschiedlichen klimatischen Bedingungen zurück zu führen ist. Allerdings scheinen Bombus spp. den höchsten Anteil an Besuchen an Standorten mit Neophyten zu haben während Solitärbienen den höchsten Anteil an Standorten ausmachten, an denen I. glandulifera entfernt wurde (Abb. 3). Darüber hinaus waren Bombus spp. an den entsprechenden Standorten besonders häufig an Blütenständen von I. glandulifera zu finden, wobei mittel- und langrüsselige Hummeln (Bombus pascuorum und B. hortorum) die Neophyte bevorzugt besuchten (Fig. 4). Allerdings lockten Standorte mit I. glandulifera nicht mehr B. pascuorum an als Neophyten-freie Standorte (Abb. 5) und auch die Diversität von Bombus spp. unterschied sich nicht zwischen “befallenen” und “nicht befallenen” Standorten. Trotzdem macht die hohe Produktion von zuckerreichem Nektar (Tab. II) I. glandulifera zu einer äußerst attraktiven Nektarquelle für die einheimischen mittel- und langrüsselige Hummeln in Irland. So mögen die Generalisten unter den Hummelarten, die eine wichtige Bedeutung für die Bestäubung haben, durch I. glandulifera als alternative Trachtquelle letztendlich sogar unterstützt werden. Andererseits werden bereits gefährdete Bestäuber durch Neophyten eventuell zusätzlich bedroht, da einheimische Pflanzen verdrängt werden. Unsere Ergebnisse lassen darauf schließen, dass die Entfernung von kleinen Ansammlungen von I. glandulifera-Pflanzen für örtlich begrenzte Naturschutzmaßnahmen Sinn macht. Es ist aber unklar, welche Auswirkungen die Entfernung von I. glandulifera an größeren Monokultur-Standorten für Hummeln und diejenigen Bestäuber hat, die diese Balsaminenart als alleinige Trachtquelle nutzen. In Langzeitstudien sollte daher untersucht werden, wie Bestäuberpopulationen auf die Verbreitung und auf die konsequente Entfernung von I. glandulifera reagieren.
Similar content being viewed by others
References
Aigner P.A. (2004) Ecological and genetic effects on demographic processes: pollination, clonality and seed production in Dithyrea maritima, Biol. Conserv. 116, 27–34.
Barker R.J. (1978) Poisoning by plants, in: Morse R.A. (Ed.), Honey bee pests, predators, and diseases, Cornell University Press, London, pp. 275–296.
Beerling D.J., Perrins J.M. (1993) Impatiens glandulifera Royle (Impatiens roylei Walp.), J. Ecol. 81, 367–382.
Biesmeijer J.C., Roberts S.P.M., Reemer M., Ohlemueller R., Edwards M., Peeters T., Schaffers A.P., Potts S.G., Kleukers R., Thomas C.D., Settele J., Kunin W.E. (2006) Parallel declines in pollinators and insect-pollinated plants in Britain and the Netherlands, Science 313, 351–354.
Bjerknes A.L., Totland Ø., Hegland S., Nielsen A. (2007) Do alien plant invasions really affect pollination success in native plant species? Biol. Conserv. 138, 1–12.
Chapin F.S., Zavaleta E.S., Eviner V.T., Naylor R.L., Vitousek P.M., Reynolds H.L., Hooper D.U., Lavorel S., Sala O.E., Hobbie S.E., Mack M.C., Diaz S. (2000) Consequences of changing biodiversity, Nature 405, 234–242.
Chittka L., Schürkens S. (2001) Successful invasion of a floral market, Nature 411, 653.
Comba L., Corbet S.A., Hunt L., Warren B. (1999) Flowers, nectar and insect visits: evaluating British plant species for pollinator-friendly gardens, Ann. Bot. 83, 369–383.
Corbet S.A., Kerstlake C.J.C., Brown D., Morland N.E. (1984) Can bees select nectar-rich flowers in a patch? J. Apic. Res. 23, 234–242.
Corbet S.A., Unwin D.M., Prys-Jones O.E. (1979) Humidity, nectar and insect visits to flowers, with special reference to Crataegus, Tilia and Echium, Ecol. Entomol. 4, 9–22.
Darvill B., Knight M.E., Goulson D. (2004) Use of genetic markers to quantify bumblebee foraging range and nest density, Oikos 107, 471–478.
Davis M.A. (2003) Biotic globalization: Does competition from introduced species threaten biodiversity?, BioScience 53, 481–489.
Fitzpatrick U., Murray T.E., Paxton R.J., Breen J., Cotton D., Santorum V., Brown M.J.F. (2007) Rarity and decline in bumblebees — a test of causes and correlates in the Irish fauna, Biol. Conserv. 136, 185–194.
Fussell M., Corbet S.A. (1992) Flower usage by bumblebees — a basis for forage plant management, J. Appl. Ecol. 29, 451–465.
Ghazoul J. (2002) Flowers at the front line of invasion? Ecol. Entomol. 27, 638–640.
Goodell K. (2008) Invasive exotic plant-bee interactions, in: James R.R., Pitts-Singer T.L. (Eds.), Bee pollination in agroecosystems, Oxford University Press, Oxford, pp. 166–183.
Harder L.D. (1983) Flower handling efficiency of bumble bees: morphological aspects of probing time, Oecologia 57, 274–280.
Heinrich B. (1976) The foraging specialization of individual bumblebees, Ecol. Monogr. 46, 105–128.
Hejda M., Pyšek P. (2006) What is the impact of Impatiens glandulifera on species diversity of invaded riparian vegetation? Biol. Conserv. 132, 143–152.
Hulme P.E., Bremner E.T. (2006) Assessing the impact of Impatiens glandulifera on riparian habitats: partitioning diversity components following species removal, J. Appl. Ecol. 43, 43–50.
Inouye D.W. (1980) The effect of proboscis and corolla tube lengths on patterns and rates of flower visitation by bumblebees, Oecologia 45, 197–201.
Johnson S.D., Steiner K.E. (2000) Generalization versus specialization in plant pollination systems, Trends Ecol. Evol. 15, 140–143.
Knight M.E., Martin A.P., Bishop S., Osborne J.L., Hale R.J., Sanderson R.A., Goulson D. (2005) An interspecific comparison of foraging range and nest density of four bumblebee (Bombus) species, Mol. Ecol. 14, 1811–1820.
Könies H., Glavač V. (1979) Über die Konkurrenzfähigkeit des Indischen Springkrautes (Impatiens glandulifera ROYLE) am Fuldaufer bei Kassel, Philippia 4, 47–59.
Levine J.M., Vilà M., D’Antonio C.M., Dukes J.S., Grigulis K., Lavorel S. (2003) Mechanisms underlying the impacts of exotic plant invasions, Proc. R. Soc. B-Biol. Sci. 270, 775–781.
Lopezaraiza-Mikel M.E. (2006) The impact of alien species on native pollination systems, PhD thesis, University of Bristol, Bristol.
Lopezaraiza-Mikel M.E., Hayes R.B., Whalley M.R., Memmott J. (2007) The impact of an alien plant on a native plant-pollinator network: an experimental approach, Ecol. Lett. 10, 539–550.
Maskell L.C., Firbank L.G., Thompson K., Bullock J.M., Smart S.M. (2006) Interactions between non-native plant species and the floristic composition of common habitats, J. Ecol. 94, 1052–1060.
Memmott J., Waser N.M. (2002) Integration of alien plants into a native flower-pollinator visitation web, Proc. R. Soc. B-Biol. Sci. 269, 2395–2399.
Minitab (2000) MINITAB™ Statistical Software for Windows, Release 13.30, State College, PA, USA.
Moragues E., Traveset A. (2005) Effect of Carpobrotus spp. on the pollination success of native plant species of the Balearic Islands, Biol. Conserv. 122, 611–619.
Morales C.L., Aizen M.A. (2006) Invasive mutualisms and the structure of plant-pollinator interactions in the temperate forests of north-west Patagonia, Argentina, J. Ecol. 94, 171–180.
Naiman R.J., Décamps H. (1997) The ecology of interfaces: riparian zones, Annu. Rev. Ecol. Syst. 28, 621–658.
Parker I.M. (1997) Pollinator limitation of Cytisus scoparius (Scotch Broom), an invasive exotic shrub, Ecology 78, 1457–1470.
Parker I.M., Haubensak K.A. (2002) Comparative pollinator limitation of two non-native shrubs: do mutualisms influence invasions? Oecologia 130, 250–258.
Perrins J., Fitter A., Williamson M. (1993) Population biology and rates of invasion of three introduced Impatiens species in the British Isles, J. Biogeogr. 20, 33–44.
Proctor M., Yeo P., Lack A. (1996) The natural history of pollination, Timber Press, Portland, Oregon.
Prowse A., Goodridge F. (2000) Pollinator visitation rates of Impatiens glandulifera and other native riparian vegetation, Aspect. Appl. Biol. 58, 249–254.
Prýs-Jones O.E., Corbet S.A. (1991) Bumblebees, Richmond Publishing Slough.
Pyšek P., Prach K. (1993) Plant invasions and the role of riparian habitats — a comparison of four species alien to central Europe, J. Biogeogr. 20, 413–420.
Pyšek P., Prach K. (1995) Invasion dynamics of Impatiens glandulifera — a century of spreading reconstructed, Biol. Conserv. 74, 41–48.
Rathcke B. (1983) Competition and facilitation among plants for pollinators, in: Real L. (Ed.), Pollination biology, Academic Press, Inc., London, pp. 305–329.
Reynolds S.C.P. (2002) A catalogue of alien plants in Ireland, National Botanic Gardens, Glasnevin, Dublin.
Richardson D.M., Allsopp N., D’Antonio C.M., Milton S.J., Rejmánek M. (2000) Plant invasions — the role of mutualisms, Biol. Rev. 75, 65–93.
Sala O.E., Chapin F.S., Armesto J.J., Berlow E., Bloomfield J., Dirzo R., Huber-Sanwald E., Hünneke L.F., Jackson R.B., Kinzig A., Leemans R., Lodge D.M., Mooney H.A., Österheld M., Poff N.L., Sykes M.T., Walker B.H., Walker M., Wall D.H. (2000) Biodiversity — global biodiversity scenarios for the year 2100, Science 287, 1770–1774.
Schürkens S., Chittka L. (2001) The significance of the invasive crucifer species Bunias orientalis (Brassicaceae) as a nectar source for central European insects, Entomol. Gen. 25, 115–120.
Showler K. (1989) The Himalayan balsam in Britain — an undervalued source of nectar, Bee World 70, 130–131.
Southwood T.R.E., Henderson P.A. (2000) Ecological methods, Oxford Blackwell Science, Oxford.
Sowig P. (1989) Effects of flowering plants patch size on species composition of pollinator communities, foraging strategies, and resource partitioning in bumblebees (Hymenoptera, Apidae), Oecologia 78, 550–558.
Starý P., Tkalců B. (1998) Bumble-bees (Hym., Bombidae) associated with the expansive touchme-not, Impatiens glandulifera in wetland biocoridors, Anz. Schädl. Schädl. Pflanzenschutz, Umweltschutz 71, 85–87.
Stout J.C., Parnell J.A.N., Arroyo J., Crowe T.P. (2006) Pollination ecology and seed production of Rhododendron ponticum in native and exotic habitats, Biodivers. Conserv. 15, 755–777.
Titze A. (2000) The efficiency of insect pollination of the neophyte Impatiens glandulifera (Balsaminaceae), Nord. J. Bot. 20, 33–42.
Traveset A., Richardson D.M. (2006) Biological invasions as disruptors of plant reproductive mutualisms, Trends Ecol. Evol. 21, 208–216.
Underwood A.J. (1997) Experiments in ecology: their logical design and interpretation using analysis of variance, Cambridge University Press, Cambridge.
Vitousek P.M., D’Antonio C.M., Loope L.L., Rejmánek M., Westbrooks R. (1997) Introduced species: a significant component of human-caused global change, New Zeal. J. Ecol. 21, 1–16.
Author information
Authors and Affiliations
Corresponding author
Additional information
Manuscript editor: Jacqueline Pierre
Rights and permissions
About this article
Cite this article
Nienhuis, C.M., Dietzsch, A.C. & Stout, J.C. The impacts of an invasive alien plant and its removal on native bees. Apidologie 40, 450–463 (2009). https://doi.org/10.1051/apido/2009005
Received:
Revised:
Accepted:
Issue Date:
DOI: https://doi.org/10.1051/apido/2009005