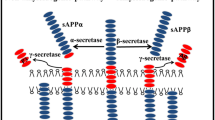
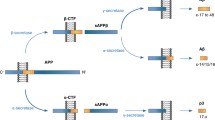
Abstract
The formation of amyloid-β oligomers plays a key role in the onset of Alzheimer’s disease. We investigated the aggregation of amyloid-β oligomers by mass spectrometry and ion mobility spectrometry, revealing those structural properties, which lead to the formation of mature fibrils. We can show that the arrangement of the first oligomers is crucial for the topology of the resulting species, leading to the formation of non-toxic aggregates or fibrils.
Article PDF
Similar content being viewed by others
Literatur
Carter J, Lippa CF (2001) Beta-amyloid, neuronal death and Alzheimer’s disease. Curr Mol Med 1: 733–737
Dobson CM (2003) Protein folding and misfolding. Nature 426: 884–890
Kumar S, Walter J (2011) Phosphorylation of amyloid beta (Aβ) peptides — a trigger for formation of toxic aggregates in Alzheimer’s disease. Aging 3: 803–812
Gremer L, Schölzel D, Schenk C et al. (2017) Fibril structure of amyloid-β(1–42) by cryo-electron microscopy. Science 358: 116–119
Cernescu M, Stark T, Kalden E et al. (2012) Laser-induced liquid bead ion desorption mass spectrometry: an approach to precisely monitor the oligomerization of the β-amyloid peptide. Anal Chem 84: 5276–5284
Seo J, Hoffmann W, Warnke S et al. (2017) An infrared spectroscopy approach to follow β-sheet formation in peptide amyloid assemblies. Nat Chem 9: 39–44
Bleiholder C, Dupuis NF, Wyttenbach T et al. (2011) Ion mobility-mass spectrometry reveals a conformational conversion from random assembly to β-sheet in amyloid fibril formation. Nat Chem 3: 172–177
Lieblein T, Zangl R, Martin J et al. (2020) Structural rearrangement of amyloid-β upon inhibitor binding suppresses formation of Alzheimer’s disease related oligomers. eLife 9: e59306
Stark T, Lieblein T, Pohland M et al. (2017) Peptidomimetics that inhibit and partially reverse the aggregation of Aβ1–42. Biochemistry 56: 4840–4849
Fokkens M, Schrader T, Klärner FG (2005) A molecular tweezer for lysine and arginine. J Am Chem Soc 127: 14415–14421
Author information
Authors and Affiliations
Corresponding author
Additional information
Funding note
Open Access funding enabled and organized by Projekt DEAL.
René Zangl 2010–2017 Studium der Chemie, Universität Frankfurt a. M. Seit 2017 Doktorand, Universität Frankfurt a. M..
Nina Morgner 1995–2002 Studium der Physik, Universität Freiburg. 2003–2008 Promotion in der physikalischen Chemie, Universität Frankfurt a. M. 2008–2010 Postdoc, Cambridge University, UK. 2010–2013 Postdoc, University of Oxford, UK. 2013–2019 Juniorprofessur mit ERC Starting Grant, Universität Frankfurt a. M. Seit 2019 Heisenbergprofessur, Universität Frankfurt a. M.
Rights and permissions
Dieser Artikel wird unter der Creative Commons Namensnennung 4.0 International Lizenz veröffentlicht, welche die Nutzung, Vervielfältigung, Bearbeitung, Verbreitung und Wiedergabe in jeglichem Medium und Format erlaubt, sofern Sie den/die ursprünglichen Autor(en) und die Quelle ordnungsgemäß nennen, einen Link zur Creative Commons Lizenz beifügen und angeben, ob Änderungen vorgenommen wurden. Die in diesem Artikel enthaltenen Bilder und sonstiges Drittmaterial unterliegen ebenfalls der genannten Creative Commons Lizenz, sofern sich aus der Abbildungslegende nichts anderes ergibt. Sofern das betreffende Material nicht unter der genannten Creative Commons Lizenz steht und die betreffende Handlung nicht nach gesetzlichen Vorschriften erlaubt ist, ist für die oben aufgeführten Weiterverwendungen des Materials die Einwilligung des jeweiligen Rechteinhabers einzuholen. Weitere Details zur Lizenz entnehmen Sie bitte der Lizenzinformation auf http://creativecommons.org/licenses/by/4.0/deed.de.
About this article
Cite this article
Zangl, R., Morgner, N. Wie kleine Amyloid-β-Peptide zum großen Problem im Gehirn werden können. Biospektrum 27, 705–708 (2021). https://doi.org/10.1007/s12268-021-1678-1
Published:
Issue Date:
DOI: https://doi.org/10.1007/s12268-021-1678-1