Zusammenfassung der Veränderungen der Leitlinien seit 2010
Das Kapitel 5 wurde neu in die Leitlinien des European Resuscitation Council (ERC) aufgenommen. Im Jahr 2010 war die Thematik Bestandteil des Kapitels „Erweiterte lebensrettende Maßnahmen (ALS)“ [1]. Der ERC hat bei der Erstellung dieser Leitlinien zur Postreanimationsbehandlung mit Vertretern der European Society of Intensive Care Medicine (ESICM) zusammengearbeitet, die die Bedeutung einer qualitativ hochwertigen Postreanimationsbehandlung als wesentliches Glied der Überlebenskette („chain of survival“) würdigen [2].
Die wichtigsten Änderungen in der Postreanimationsbehandlung seit 2010 beinhalten:
-
Die Notwendigkeit einer vordringlichen Koronarangiographie (Herzkatheteruntersuchung) und perkutanen koronaren Intervention (PCI) nach außerklinischem Kreislaufstillstand mit vermutet kardialer Ursache wird noch stärker betont.
-
Ein zielgerichtetes Temperaturmanagement bleibt wichtig, aber es besteht jetzt auch die Option, eine Temperatur von 36 °C statt wie bisher 32–34 °C anzustreben
-
Prognoseerstellungen werden jetzt anhand einer multimodalen Strategie vorgenommen. Dabei liegt der Schwerpunkt darauf, einer neurologischen Erholung und vollständigen Eliminierung verabreichter Sedativa genügend Zeit zu gewähren.
-
Es wurde ein neues Kapitel hinzugefügt, welches sich mit der Rehabilitation nach einem überlebten Kreislaufstillstand befasst. Die Empfehlungen beinhalten den systematischen Aufbau der Nachbetreuung, die ein Screening auf mögliche kognitive und emotionale Defizite und die Erteilung von Auskünften beinhaltet.
Einleitung
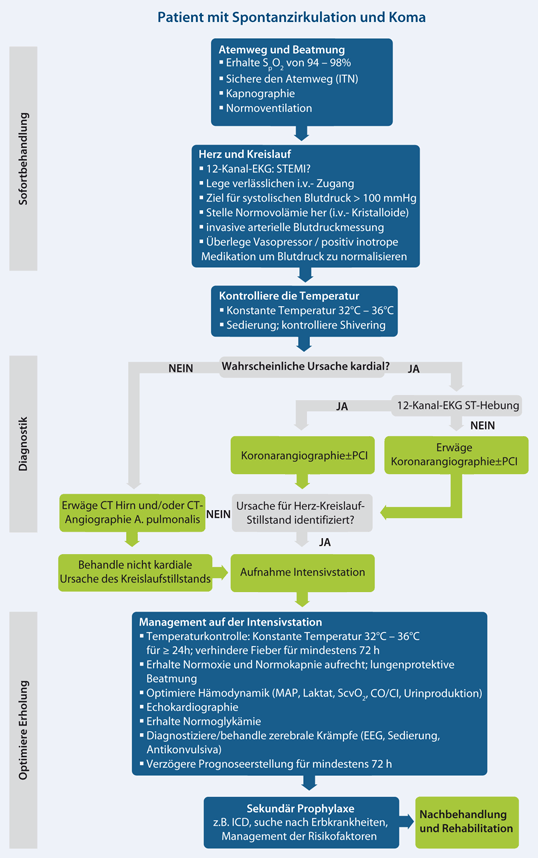
ROSC („return of spontaneous circulation“) ist der erste Schritt auf dem Weg zur vollständigen Erholung nach einem Kreislaufstillstand. Die komplexen pathophysiologischen Prozesse, welche nach einer Ischämie, die bei einem Kreislaufstillstand den ganzen Körper betrifft, auftreten, und die nachfolgende Reperfusionsantwort während und nach erfolgreicher Wiederbelebung werden als Postreanimationssyndrom („post-cardiac arrest-syndrome“) bezeichnet [3]. In Abhängigkeit von der Ursache des Kreislaufstillstands und dem Schweregrad des Postreanimationssyndroms benötigen viele Patienten eine multiple Organunterstützung. Die Behandlung in dieser Postreanimationsphase beeinflusst signifikant das allgemeine Ergebnis und insbesondere die Qualität der neurologischen Erholung [4–11]. Die Postreanimationsbehandlung beginnt dort, wo ROSC erreicht wurde. Sobald der Patient stabilisiert ist, wird er in die am besten geeignete intensivmedizinische Einheit eingeliefert (z. B. Notaufnahme, Herzkatheterlabor oder Intensivstation), um die Diagnostik, Überwachung und Behandlung fortzuführen. Der Algorithmus zur Postreanimationsbehandlung (Abb. 1) umreißt einige der Kerninterventionen, die zur Optimierung des Outcome für diese Patienten erforderlich sind.
Einige Patienten wachen nach einem Kreislaufstillstand schnell wieder auf, einige Berichte sprechen von 15–46 % der Patienten, die nach einem außerklinischem Kreislaufstillstand in ein Krankenhaus eingeliefert wurden [12–14]. Diese Zahlen werden beeinflusst von den Reaktionszeiten, dem Anteil der Ersthelferreanimation, der Zeit bis zur 1. Defibrillation und der Dauer der Reanimation. Obwohl keine Daten hierzu vorliegen, ist bei jeglichem Zweifel bezüglich der neurologischen Funktion eines Patienten die Empfehlung sinnvoll, ihn endotracheal zu intubieren und die Behandlung zur Optimierung der hämodynamischen, respiratorischen und metabolischen Parameter zusammen mit einem zielgerichteten Temperaturmanagement entsprechend dem lokalen standardisierten Therapieplan zu beginnen. Von diesen nach einem Kreislaufstillstand komatös auf einer Intensivstation aufgenommenen Patienten werden abhängig von der Ursache des Kreislaufstillstands und vom System und der Qualität der Versorgung 40–50 % lebend aus der Klinik entlassen [7, 10, 13–20]. Von diesen haben die meisten ein gutes neurologisches Outcome, wobei viele dennoch geringgradige kognitive Defizite aufweisen.
Postreanimationssyndrom
Das Postreanimationssyndrom umfasst die zerebralen Postreanimationsschädigungen, die kardiale Postreanimationsdysfunktion, die systemische Antwort auf Ischämie und Reperfusion und die persistierende, den Kreislaufstillstand auslösende Pathologie [3, 25, 26]. Der Schweregrad dieses Syndroms variiert je nach Dauer und Ursache des Kreislaufstands. Bei nur kurzer Dauer tritt es nicht zwingend auf. Zerebrale Postreanimationsschädigungen manifestieren sich als Koma, Krampfanfälle, Myoklonien, neurokognitive Dysfunktion in unterschiedlicher Ausprägung bis hin zum Hirntod. Bei den Patienten, die bis zur Aufnahme auf einer Intensivstation überleben, jedoch dann in der Klinik versterben, ist eine zerebrale Schädigung die Ursache für etwa zwei Drittel der Todesfälle nach außerklinischem und etwa 25 % nach innerklinischem Kreislaufstillstand [27–30]. Kardiovaskuläres Versagen ist ursächlich für die meisten Todesfälle in den ersten 3 Tagen, während zerebrale Schädigungen für die meisten späteren Todesfälle verantwortlich sind [27, 30, 31]. Bei Patienten mit schlechter Prognose ist der Entzug lebenserhaltender Maßnahmen („withdrawal of life sustaining therapy“, WLST) die häufigste Todesursache (etwa 50 %), [14, 30] was die Bedeutung der Prognosestrategie hervorhebt (s. u.). Die zerebrale Schädigung in der Postreanimationsphase wird möglicherweise verschlimmert durch Versagen der Mikrozirkulation, Beeinträchtigung der Autoregulation, Hypotonie, Hyperkapnie, Hypoxie und Hyperoxie, Fieber, Hypo- und Hyperglykämie und durch zerebrale Krampfanfälle. Ausgeprägte myokardiale Funktionsstörungen treten nach einem Kreislaufstillstand häufig auf, beginnen aber, sich üblicherweise ab dem 2. bis 3. Tag zurückzubilden, wobei die vollständige Erholung erheblich länger dauern kann [32–34]. Die systemische Antwort auf Ischämie und Reperfusion nach einem Kreislaufstillstand aktiviert immunologische Prozesse und das Gerinnungssystem, trägt damit zur Entstehung eines Multiorganversagens bei und erhöht das Risiko für Infektionen [35–41]. Daher hat das Postreanimationssyndrom viele Gemeinsamkeiten mit einer Sepsis inklusive der intravaskulären Volumenverschiebungen, Vasodilatation, Endothelschäden und gestörter Mikrozirkulation [42–48].
Atemweg und Atmung
Kontrolle der Oxygenierung
Patienten, die nur eine kurze Kreislaufstillstandszeit hatten und sofort auf die entsprechende Therapie reagierten, können unmittelbar ihre normale Hirnfunktion wiedererlangen. Sie benötigen keine Intubation und Beatmung, sollen jedoch Sauerstoff über eine Gesichtsmaske erhalten, wenn ihre arterielle Sauerstoffsättigung weniger als 94 % beträgt. Hypoxie und Hyperkapnie erhöhen die Wahrscheinlichkeit eines weiteren Kreislaufstillstands und können zu sekundären Hirnschädigungen beitragen. Einige Tierversuche weisen darauf hin, dass eine Hyperoxie kurz nach ROSC oxidativen Stress verursacht und postischämisch Neurone schädigt [49–53]. Ein Tierversuch zeigte, dass die Anpassung der inspiratorischen Sauerstoffkonzentration (FiO2) an die Erreichung einer arteriellen Sauerstoffsättigung von 94–96 % in der ersten Stunde nach ROSC (kontrollierte Reoxygenierung) ein besseres neurologisches Outcome bewirkte als die Beatmung mit 100 % Sauerstoff [54]. Eine klinische Registerauswertung mit mehr als 6000 Patienten unterstützt diese Tierversuchsergebnisse und zeigt, dass Hyperoxie in den ersten 24 h nach Kreislaufstillstand mit einem schlechteren Outcome einhergeht als Normoxie und Hypoxie [55]. Eine weitere Analyse derselben Arbeitsgruppe zeigte, dass der Zusammenhang zwischen Hyperoxie und Outcome dosisabhängig war und dass es nicht nur einen Grenzwert für das Entstehen einer Schädigung gab [56]. Eine Observationsstudie, in die ausschließlich Patienten eingeschlossen waren, die mit induzierter milder Hypothermie behandelt wurden, dokumentierte ebenfalls einen Zusammenhang zwischen Hyperoxie und schlechtem Outcome [57]. Im Gegensatz dazu zeigte eine Observationsstudie an über 12.000 Patienten nach Kreislaufstillstand, dass die Hyperoxie nach der Regulierung der inspiratorischen Sauerstoffkonzentration und anderer relevanter Kovariablen (inklusive der Krankheitsschwere) nicht mehr mit der Mortalität zusammenhing [58]. Eine Metaanalyse von 14 Observationsstudien deutete auf eine signifikante Heterogenität der Ergebnisse aller Studien hin [59].
Die Tierversuche, die einen Zusammenhang zwischen Hyperoxie und schlechterem neurologischem Outcome nach einem Kreislaufstillstand zeigen, haben regelhaft den Effekt einer Hyperoxie in der ersten Stunde nach ROSC untersucht. Für die klinische Praxis bedeutet dies, dass die inspiratorische Sauerstoffkonzentration, insbesondere auch außerklinisch, unmittelbar nach ROSC bedarfsgerecht eingestellt werden soll. Die einzige prospektive klinische Studie, in der die Einstellung der Sauerstoffkonzentration auf einen definierten Zielbereich (in diesem Fall eine Sauerstoffsättigung von 90–94 %) mit der Applikation von 100 % Sauerstoff nach einem außerklinischen Kreislaufstillstand verglichen wurde, wurde bereits nach Einschluss von 19 Patienten beendet, da es sich als sehr schwierig herausgestellt hatte, die arterielle Sauerstoffsättigung pulsoxymetrisch zuverlässig zu messen [60]. Eine aktuelle Studie, die Raumluftatmung mit der zusätzlichen Gabe von Sauerstoff bei Patienten mit ST-Hebungsinfarkt verglich, zeigte, dass eine zusätzliche Sauerstoffgabe die Myokardläsion, die Reinfarktrate und die Zahl schwerwiegender Herzrhythmusstörungen erhöhte und mit einer Vergrößerung des infarzierten Areals nach 6 Monaten vergesellschaftet war [61].
Die schädigende Wirkung von Sauerstoff nach einem Myokardinfarkt gilt als erwiesen, ebenso die Möglichkeit einer Verstärkung der neurologischen Schädigung nach einem Kreislaufstillstand. Demzufolge soll, sobald eine verlässliche Bestimmung der arteriellen Sauerstoffsättigung möglich ist (mittels Blutgasanalyse und/oder Pulysoxymetrie), die inspiratorische Sauerstoffkonzentration so angepasst werden, dass die arterielle Sauerstoffsättigung zwischen 94 und 98 % liegt. Vermeiden Sie eine Hypoxämie, die ebenfalls schadet, sichern Sie eine verlässliche Messung der O2-Sättigung, bevor sie die Sauerstoffkonzentration senken.
Kontrolle der Ventilation
Die endotracheale Intubation, Sedierung und kontrollierte Beatmung muss bei jedem Patienten mit eingeschränkter zerebraler Funktion erwogen werden. Vergewissern Sie sich, dass der Endotrachealtubus korrekt und deutlich oberhalb der Carina platziert ist. Hypokapnie führt zu zerebraler Vasokonstriktion und einem verminderten zerebralen Blutfluss [62]. Nach einem Kreislaufstillstand bedingt eine durch Hyperventilation verursachte Hypokapnie eine zerebrale Ischämie [63–67]. Auf Daten aus Reanimationsregistern beruhende Observationsstudien belegen einen Zusammenhang zwischen Hypokapnie und schlechtem neurologischem Outcome [68–69]. Zwei Observationsstudien haben einen Zusammenhang zwischen einer milden Hyperkapnie und einem besseren neurologischen Outcome bei Patienten nach Kreislaufstillstand auf der Intensivstation dokumentiert [69, 70]. Bis zur Verfügbarkeit prospektiver Daten erscheint es vernünftig, die Beatmung so zu steuern, dass eine Normokapnie erreicht wird, und diese durch Kontrolle des endtidalen PCO2 und durch Blutgasanalysen zu überwachen. Eine Absenkung der Körpertemperatur reduziert den Stoffwechsel und kann das Risiko der Entstehung einer Hypokapnie während dieser Maßnahme erhöhen [71].
Obwohl protektive Beatmungsstategien nicht eigens an Patienten nach einem Kreislaufstillstand untersucht wurden, erscheint es vernünftig, eine protektive Lungenbeatmung anzuwenden, da erwiesen ist, dass diese Patienten eine deutliche Entzündungsreaktion entwickeln: Atemzugvolumen von 6–8 ml/kg ideales Körpergewicht und positiv endexspiratorischer Druck von 4–8 cm H2O [48, 72].
Zur Entlastung des Magens soll eine Magensonde eingelegt werden; eine durch Mund-zu-Mund- oder Beutel-Maske-Beatmung verursachte Magenüberblähung führt zu einem Zwerchfellhochstand und erschwert die Beatmung. Zur Reduzierung des Sauerstoffverbrauchs sollen Sedativa in ausreichender Dosierung verabreicht werden. Die Protokollierung der Sedativagabe wird ausdrücklich empfohlen. Bolusgaben von Muskelrelaxanzien können erforderlich sein, v. a. bei der Anwendung eines zielgerichteten Temperaturmanagements (TTM; s. u.). Eine begrenzte Datenlage zeigt, dass die befristete Infusion (≤ 48 h) kurz wirksamer Muskelrelaxanzien zur Reduzierung der Gegenatmung des Patienten und des Risikos eines Barotraumas bei ARDS-Patienten nicht mit einem erhöhten Risiko für eine auf der Intensivstation erworbene generalisierte Muskelschwäche zusammenhängt, sondern das Outcome der Patienten verbessern kann [73]. Einige Daten weisen darauf hin, dass eine kontinuierliche Muskelrelaxierung mit einer reduzierten Mortalität bei Patienten nach Kreislaufstillstand einhergeht [74]. Die kontinuierliche Gabe von Muskelrelaxanzien behindert allerdings die klinische Untersuchung und kann zerebrale Krampfanfälle maskieren. Insbesondere bei relaxierten Patienten wird die kontinuierliche Elektroenzephalographie (EEG) empfohlen, um zerebrale Krampfanfälle zu erkennen. Eine Röntgenaufnahme des Thorax soll angefertigt werden, um die Lage des Endotrachealtubus, der Magensonde und der zentralen Venenzugänge zu kontrollieren, ein eventuelles Lungenödem zu diagnostizieren und Komplikationen der Reanimationsmaßnahmen wie einen durch Rippenfrakturen verursachten Pneumothorax zu erkennen [76, 77].
Kreislauf
Koronare Reperfusion
Das akute Koronarsyndrom (ACS) ist eine häufige Ursache für einen außerklinischen Kreislaufstillstand (OHCA): Eine kürzliche Metaanalyse ergab, dass Patienten mit OHCA ohne eindeutig nicht kardiale Ursache in 59–71 % überwiegend eine akute Koronararterienläsion aufwiesen [78]. Seit der Veröffentlichung einer wegweisenden Studie im Jahr 1997 [79] zeigten viele Observationsstudien, dass eine notfallmäßige Koronarangiographie inklusive einer frühen perkutanen koronaren Intervention (PCI) bei Patienten mit ROSC nach einem Kreislaufstillstand möglich ist [80, 81]. Das invasive Vorgehen bei diesen Patienten (d. h. frühe Koronarangiographie, gefolgt von einer sofortigen PCI, falls erforderlich), insbesondere bei prolongierter Reanimation und unspezifischen EKG-Veränderungen, wird wegen des Fehlens eindeutiger Evidenz und wegen erheblicher Auswirkungen auf den Einsatz der vorhandenen Ressourcen (inklusive des Transports der Patienten zu den PCI-Zentren) kontrovers gesehen.
Perkutane koronare Intervention nach ROSC mit ST-Hebung
Über 80 % der Patienten mit ST-Hebung oder Linksschenkelblock (LSB) im EKG nach ROSC haben eine akute koronare Läsion [82]. Da viele Observationsstudien von höheren Überlebensraten und von einem besseren neurologischen Outcome berichten, ist es sehr wahrscheinlich, dass ein frühes invasives Vorgehen für Patienten mit ST-Hebung von Vorteil ist, auch wenn hierzu keine randomisierten Studien vorliegen [83]. Angesichts der verfügbaren Daten soll bei erwachsenen Patienten mit ROSC nach OHCA mit vermuteter kardialer Ursache und ST-Hebung im EKG notfallmäßig eine Koronarangiographie und, wenn erforderlich, eine sofortige PCI durchgeführt werden. Diese Empfehlung beruht allerdings auf einer geringen Evidenz anhand von Untersuchungen an ausgewählten Populationen. Einige Observationsstudien weisen auch darauf hin, dass ein optimales Outcome nach außerklinischem Kreislaufstillstand durch die Kombination von zielgerichtetem Temperaturmanagement (TTM) und PCI erreicht wird. Die Kombination von TTM und PCI kann als Teil einer allgemeinen Strategie zur Verbesserung der Überlebensrate mit vollständiger neurologischer Erholung in einen standardisierten Therapieplan für Patienten nach Kreislaufstillstand aufgenommen werden [81, 84, 85].
Perkutane koronare Intervention nach ROSC ohne ST-Hebung
Im Vergleich zu einem ACS bei Patienten ohne Kreislaufstillstand sind die Standardmethoden zur Beurteilung einer Koronarischämie bei Patienten nach einem Kreislaufstillstand weniger zuverlässig. Die Sensitivität und Spezifität der üblichen klinischen Parameter, des EKG und der Biomarker zur Einschätzung eines akuten Koronararterienverschlusses als Ursache für den Kreislaufstillstand sind nicht geklärt [86–89]. Einige große Observationsstudien konnten zeigen, dass Patienten mit ROSC nach OHCA auch ohne ST-Hebung ein ACS haben können [90–93]. Für diese Patienten ohne ST-Hebung existieren widersprüchliche Daten hinsichtlich des potenziellen Nutzens einer notfallmäßigen Koronarangiographie [92, 94, 95]. In einer kürzlich konsentierten Stellungnahme hat die European Association for Percutaneous Cardiovascular Interventions (EAPCI) betont, dass bei Patienten nach OHCA mit ST-Hebung eine Koronarangiographie sofort erfolgen soll. Bei den übrigen Patienten ohne deutlichen Hinweis auf eine nicht kardiale Ursache soll eine Koronarangiographie schnellstmöglich (≤ 2 h) durchgeführt werden, insbesondere bei Vorliegen einer hämodynamischen Instabilität [96]. Derzeit wird dieses Vorgehen bei Patienten ohne ST-Hebung kontrovers gesehen und nicht von allen Experten akzeptiert. Dennoch ist es vernünftig, eine notfallmäßige Koronarangiographie nach ROSC bei denjenigen Patienten zu diskutieren und zu erwägen, bei denen das Risiko für eine koronare Ursache des Kreislaufstillstands sehr hoch ist. Faktoren wie Alter des Patienten, Dauer der Reanimation, hämodynamische Instabilität, aktueller Herzrhythmus, neurologischer Status bei Klinikaufnahme und die gefühlte Wahrscheinlichkeit einer kardialen Genese können die Entscheidung beeinflussen, ob die Intervention in der akuten Phase durchgeführt oder auf einen späteren Zeitpunkt während des Klinikaufenthalts verschoben wird.
Indikation und Zeitpunkt für die Computertomographie (CT)
Die kardialen Ursachen für einen OHCA wurden in den letzten Jahrzehnten ausgiebig untersucht. Im Gegensatz dazu ist sehr wenig über nicht kardiale Ursachen bekannt. Die frühe Feststellung einer respiratorischen oder neurologischen Ursache würde die Verlegung dieser Patienten auf eine darauf spezialisierte Intensivstation mit der bestmöglichen Behandlung ermöglichen. Eine verbesserte Kenntnis der Prognose würde auch die Diskussion darüber erlauben, ob bestimmte therapeutische Maßnahmen angebracht sind, wie z. B. ein TTM. Die frühe Feststellung einer respiratorischen oder neurologischen Ursache kann mit der Durchführung eines Schädel- und Thorax-CT bei Klinikaufnahme vor oder nach der Koronarangiographie erreicht werden. Bei fehlenden Läsionen, Anzeichen oder Symptomen für eine respiratorische oder neurologische Ursache (z. B. Kopfschmerzen, zerebrale Krampfanfälle, neurologische Defizite mit neurologischer Ursache, Kurzatmigkeit oder bekannte Hypoxie bei Patienten mit bekannter und fortschreitender Erkrankung der Atemwege) oder bei Vorliegen klinischer oder im EKG verifizierter Beweise für eine koronare Ischämie wird die Koronarangiographie vor der CT durchgeführt. In verschiedenen Kasuistiken konnte gezeigt werden, dass dieses Vorgehen die Diagnose nicht kardialer Ursachen eines Kreislaufstillstands bei einem erheblichen Anteil der Patienten ermöglicht [97, 98]. Bei Patienten mit einem Kreislaufstillstand traumatischer oder hämorrhagischer Ursache kann ein Ganzkörper-CT indiziert sein [99, 100].
Hämodynamisches Management
Nach Reanimation auftretende myokardiale Dysfunktionen verursachen eine hämodynamische Instabilität, die sich als Hypotonie, niedriger Cardiac-Index und in Form von Arrhythmien manifestiert [32, 101]. Eine frühe Echokardiographie bei allen Patienten erlaubt die Feststellung und die Quantifizierung der myokardialen Beeinträchtigung [33, 102]. Nach Reanimation auftretende myokardiale Dysfunktionen erfordern häufig eine zumindest vorübergehende Unterstützung mit positiv inotropen Substanzen. Basierend auf experimentellen Daten ist Dobutamin die am meisten etablierte Substanz in diesem Zusammenhang, [103, 104]. Aber die bei Patienten nach einem Kreislaufstillstand häufig auftretende systemische Entzündungsreaktion kann auch ursächlich für eine Vasoplegie und eine ausgeprägte Vasodilatation sein [32]. Aus diesem Grund besteht die effektivste Therapie in der Gabe von Noradrenalin – mit oder ohne die zusätzliche Gabe von Dobutamin – und Volumen. Die Infusion relativ großer Volumenmengen wird von Patienten mit Postreanimationssyndrom bemerkenswert gut toleriert [7, 8, 32]. Wenn die Behandlung mit Volumen und inotropen und vasoaktiven Substanzen nicht zur Stabilisierung des Kreislaufs ausreicht, soll die Anlage eines mechanischen Kreislaufunterstützungssystems (z. B. IMPELLA, Abiomed, USA) in Erwägung gezogen werden [7, 105].
Die Therapie kann anhand von Blutdruck, Herzfrequenz, Urinproduktion, Rate der Plasma-Lactat-Clearance und der zentralvenösen Sauerstoffsättigung geführt werden. Die Echokardiographie muss eventuell auch wiederholt zum Einsatz kommen, insbesondere bei hämodynamisch instabilen Patienten. Im Rahmen der Intensivtherapie ist das Anlegen einer arteriellen Kanüle zur kontinuierlichen Blutdruckmessung essenziell. Messungen des Herzzeitvolumens können bei der Behandlung hämodynamisch instabiler Patienten hilfreich sein, aber es gibt keine Evidenz dafür, dass dadurch das Outcome beeinflusst wird. Einige Zentren befürworten bei Patienten im kardiogenen Schock immer noch die Nutzung einer intraaortalen Ballonpumpe (IABP), obwohl die IABP-Shock-II-Studie nicht zeigen konnte, dass der Einsatz der IABP die 30-Tage-Überlebensrate bei Patienten mit Myokardinfarkt und kardiogenem Schock steigern konnte [106, 107].
Vergleichbar der bei der Behandlung der Sepsis empfohlenen „Early Goal-Directed Therapy“ [108] – obwohl diese durch mehrere neue Studien infrage gestellt wird [109–111] – wird eine Anzahl therapeutischer Maßnahmen, wie ein spezifisches Blutdruckziel, als Behandlungsstrategie nach einem Kreislaufstillstand vorgeschlagen [8]. Deren Einfluss auf das Outcome ist nicht sicher erwiesen, und die anzustrebenden optimalen Werte für den mittleren und/oder systolischen Blutdruck bleiben nach wie vor ungeklärt [7, 8, 112–114]. In einer Observationsstudie an 151 Patienten nach einem Kreislaufstillstand konnte gezeigt werden, dass ein Zusammenhang zwischen einem mittleren arteriellen Blutdruck (Messung alle 15 min) von mehr als 70 mmHg und einem guten neurologischen Outcome besteht [113]. Eine kürzliche Studie ergab eine inverse Beziehung zwischen mittlerem arteriellem Druck und Mortalität [101]. Dennoch bleibt ungeklärt, ob der Einsatz vasoaktiver Substanzen zur Erreichung eines derartigen Zielwerts für den Blutdruck zu einem besseren neurologischen Outcome führt. Aufgrund fehlender definitiver Daten soll der mittlere arterielle Blutdruck so eingestellt werden, dass eine ausreichende Urinproduktion (1 ml/kg/h) und ein normaler oder zumindest sinkender Plasma-Lactat-Wert erreicht werden, wobei der normale Blutdruck des Patienten, die Ursache des Kreislaufstillstands und das Ausmaß jeglicher myokardialer Dysfunktion zu berücksichtigen sind [3]. Diese Zielwerte können unterschiedlich sein, je nach der individuellen Physiologie und bestehenden Begleiterkrankungen. Es ist zu beachten, dass eine Hypothermie die Urinproduktion steigern [115] und die Lactat-Clearance vermindern [101] kann.
In einer retrospektiven Studie wurde eine Tachykardie mit einem schlechten Outcome in Zusammenhang gebracht [116]. Während therapeutischer milder Hypothermie besteht die normale physiologische Antwort in einer Bradykardie. Diese Reaktion konnte in Tierversuchen demonstriert werden. Sie dient der Reduzierung der üblicherweise in der Frühphase nach einem Kreislaufstillstand auftretenden diastolischen Dysfunktion (Dysregulation) [117]. Früher wurde eine Bradykardie als Nebenwirkung betrachtet, insbesondere bei einer Frequenz von < 40/min. Kürzlich veröffentlichte retrospektive Studien haben indes ergeben, dass eine Bradykardie mit einem guten Outcome vergesellschaftet ist [118, 119]. Auch eine Bradykardie von ≤ 40/min. kann unbehandelt bleiben, solange Blutdruck, Lactat, SvO2 und Urinproduktion ausreichend sind. Es ist wesentlich, dass der Sauerstoffbedarf während therapeutischer milder Hypothermie vermindert ist.
Eine relative Nebenniereninsuffizienz tritt nach einer erfolgreichen Reanimation häufig auf und scheint mit einer schlechten Prognose zusammenzuhängen, wenn sie von einem „post-resuscitation shock“ begleitet wird [120, 121]. In zwei kontrolliert randomisierten Studien an 380 Patienten mit innerklinischem Kreislaufstillstand (IHCA) konnte eine verbesserte ROSC-Rate gezeigt werden, wenn Methylprednisolon und Vasopressin zusätzlich zu Adrenalin eingesetzt wurden, im Vergleich zur alleinigen Gabe von Placebo und Adrenalin: kombinierte RR 1,34 (95 %-CI 1,21–1,43) [122, 123]. Es sind keine Studien verfügbar, die die alleinige Zugabe von Steroiden zur Standardtherapie des IHCA untersucht haben. Die genannten Studien stammen von einer einzelnen Forschergruppe, wobei die untersuchte Population einen sehr schnellen Beginn der ALS-Maßnahmen, einen hohen Anteil asystoler Kreislaufstillstände und eine niedrige Basisüberlebensrate im Vergleich zu anderen IHCA-Studien aufwies. Weitere bestätigende Untersuchungen werden erwartet, aber solange noch keine belastbaren Daten vorliegen, sollen keine Steroide nach einem IHCA gegeben werden. Für den routinemäßigen Einsatz von Steroiden nach OHCA gibt es ebenfalls keine Evidenz.
Unmittelbar nach einem Kreislaufstillstand folgt typischerweise eine Periode der Hyperkaliämie. Danach sorgen freigesetzte endogene Katecholamine und die Korrektur einer metabolischen und respiratorischen Azidose für eine intrazelluläre Verschiebung des Kaliums, wodurch eine Hypokaliämie ausgelöst wird. Diese Hypokaliämie kann zu ventrikulären Arrhythmien prädisponieren. Es soll Kalium verabreicht werden, um einen Kaliumspiegel zwischen 4,0 und 4,5 mmol/l aufrechtzuerhalten.
Implantierbare Kardioverter-Defibrillatoren
Bei ischämischen Patienten mit ausgeprägter linksventrikulärer Dysfunktion, die nach einer ventrikuläre Arrhythmie erfolgreich reanimiert wurden, welche später als 24–48 h nach einem primären koronaren Ereignis auftrat, soll an den Einbau eines implantierbaren Kardioverter-Defibrillators (ICD) gedacht werden [124–126]. Durch einen ICD kann auch die Mortalität bei den Patienten gesenkt werden, die einen Kreislaufstillstand überlebt haben und bei denen das Risiko eines plötzlichen Herztods aufgrund von strukturellen Herzerkrankungen oder angeborenen Kardiomyopathien besteht [127, 128]. In jedem Fall soll eine spezielle elektrophysiologische Beurteilung erfolgen, bevor die Implantation eines ICD als sekundäre Prophylaxe für einen plötzlichen Herztod verworfen wird.
Behinderung (Optimierung der neurologischen Erholung)
Zerebrale Perfusion
Es konnte in Tierversuchen gezeigt werden, dass unmittelbar nach ROSC eine kurze Periode eines multifokalen zerebralen „No-Reflow“-Phänomens auftritt, gefolgt von einer ca. 15–30-minütigen, vorübergehenden globalen Hyperämie [129–131]. Diese Phase wird abgelöst von einer bis zu 24-stündigen Hypoperfusion, während sich der zerebrale Sauerstoffgrundumsatz allmählich erholt. Nach einem asphyktischen Kreislaufstillstand kann nach ROSC ein vorübergehendes Hirnödem auftreten, welches aber selten zu einer klinisch relevanten Hirndrucksteigerung führt [132, 133]. Bei vielen Patienten ist die Autoregulation des zerebralen Blutflusses für einige Zeit nach dem Kreislaufstillstand gestört, was bedeutet, dass die Hirnperfusion vom zerebralen Perfusionsdruck abhängt und nicht von der neuronalen Aktivität [134, 135]. Eine Studie, die die Messung der regionalen zerebralen Oxygenierung mittels Nahinfrarotspektroskopie bestimmte, kam zu dem Ergebnis, dass die Autoregulation bei 35 % der Patienten nach einem Kreislaufstillstand gestört war, wobei die Mehrheit dieser Patienten vor dem Kreislaufstillstand an einem Hypertonus litt [136]. Das ermuntert dazu, die Empfehlung zu wiederholen, die der ERC bereits 2010 in seinen Leitlinien aussprach: Der arterielle Blutdruck soll nach ROSC etwa auf dem für den Patienten üblichen Niveau gehalten werden [1]. Es besteht aber noch ein erhebliches Wissensdefizit darin, wie die Körpertemperatur den optimalen Blutdruck beeinflusst.
Sedierung
Obgleich es allgemein üblich ist, Patienten nach ROSC für mindestens 24 h zu sedieren und zu beatmen, gibt es keine verlässlichen Daten, die eine konkrete Zeitspanne für die Beatmung, Sedierung und Relaxierung nach einem Kreislaufstillstand begründen. Während einer therapeutischen Hypothermie müssen die Patienten gut sediert werden, die Dauer von Sedierung und Beatmung wird deshalb von dieser Therapie beeinflusst. Eine Metaanalyse der zur Sedierung während therapeutischer milder Hypothermie benutzten Medikamente ergab beträchtliche Unterschiede zwischen 68 Intensivstationen in verschiedenen Ländern [137]. Es gibt keine Daten, ob die Wahl des Sedativums das Outcome beeinflusst, üblicherweise wird eine Kombination von Opioid und Hypnotikum verwendet. Kurz wirksame Medikamente (z. B. Propofol, Alfentanil, Remifentanil) erlauben eine zuverlässigere und frühere neurologische Beurteilung und Prognoseerstellung („Prognoseerstellung“ s. u.) [138]. Auch volatile Anästhetika kommen bei der Sedierung von Patienten nach einem Kreislaufstillstand zur Anwendung [139]. Es sind einige Daten aus Tierversuchen verfügbar, die auf myokardiale und neurologische Vorteile hinweisen [140], aber es gibt keine klinischen Ergebnisse, die den Vorteil dieser Strategie untermauern. Adäquate Sedierung verringert den Sauerstoffverbrauch. Unter Hypothermie verringert oder verhindert die Sedierung Kältezittern, weshalb die Zieltemperatur schneller erreicht werden kann. Die Überwachung der Patienten mit Sedierungsscores kann hilfreich sein (z. B. Richmond- oder Ramsey-Score) [141, 142].
Kontrolle von zerebralen Krampfanfällen
Zerebrale Krampfanfälle nach einem Kreislaufstillstand sind häufig und treten bei etwa einem Drittel der Patienten auf, die nach ROSC bewusstlos bleiben. Am häufigsten sind Myoklonien bei 18–25 % der Patienten, die übrigen Patienten entwickeln fokale oder generalisierte tonisch-klonische Krampfanfälle oder eine Kombination von Krampfanfällen unterschiedlicher Genese [31, 143–145]. Klinisch sichtbare Krampfanfälle einschließlich Myoklonien können epileptischen Ursprungs sein oder auch nicht. Andere Manifestationen können fälschlicherweise für Krampfanfälle gehalten werden [146]. Es gibt mehrere Arten von Myoklonien [147], von denen die Mehrzahl nicht epileptischen Ursprungs ist. Bei Patienten mit der klinischen Manifestation von Krampfanfällen ist eine wiederholte Elektroenzephalographie zur Feststellung epileptischer Aktivität angezeigt. Bei Patienten mit einem diagnostisch gesicherten Status epilepticus und wirksamer Therapie soll eine kontinuierliche EEG-Überwachung erwogen werden.
Bei komatösen Patienten nach Kreislaufstillstand wird eine epileptiforme Aktivität gewöhnlich mithilfe des EEG festgestellt. Eindeutige Krampfaktivität, entsprechend exakter EEG-Terminologie [148], ist weniger häufig, aber ein postanoxischer Status epilepticus wurde in 23–31 % der Patienten festgestellt, die kontinuierlich EEG-überwacht wurden einschließlich mehrerer EEG-Kriterien [75, 149, 150]. Patienten mit einem elektrographisch nachgewiesenen Status epilepticus können eine klinisch feststellbare Krampfmanifestation haben, die aber auch durch Sedierung maskiert sein kann. Es ist nicht bekannt, ob der gezielte Nachweis und die Behandlung elektrographischer epileptischer Aktivität das Outcome der Patienten verbesseren.
Krampfanfälle können den zerebralen Metabolismus erhöhen [151] und haben das Potenzial, die durch einen Kreislaufstillstand verursachten Hirnschäden zu aggravieren: Sie sollen mit Natriumvalproat, Levetiracetam, Phenytoin, Benzodiazepinen, Propofol oder Barbituraten therapiert werden. Insbesondere Myoklonien sind manchmal schwierig zu behandeln, wobei Phenytoin oft unwirksam ist. Propofol ist wirksam bei der Unterdrückung postanoxischer Myoklonien [152]. Clonazepam, Natriumvalproat und Levitiracetam können bei der Behandlung postanoxischer Myoklonien ebenfalls wirksam sein [147]. Eine nachhaltige und wirksame Therapie soll unmittelbar nach dem ersten Ereignis begonnen werden, wobei vorab mögliche auslösende Ursachen (z. B. intrakranielle Blutung, Elektrolytstörungen) ausgeschlossen werden müssen.
Die prophylaktische Gabe von Antikonvulsiva bei erwachsenen Patienten nach einem Kreislaufstillstand wurde bisher nur unzureichend untersucht [153, 154]. Eine routinemäßige Krampfprophylaxe bei Patienten nach einem Kreislaufstillstand wird wegen der Gefahr von Nebenwirkungen und wegen des unzureichenden Ansprechens von Patienten mit klinischen und elektrographischen Krampfanfällen auf Antiepileptika nicht empfohlen.
Myoklonien und elektrographische Krampfaktivität einschließlich des Status epilepticus sind Bestandteil einer schlechten Prognose, wobei auch einzelne Patienten mit gutem Outcome überleben können (s. „Prognoseerstellung“) [145, 155]. Nach der Behandlung von Krampfanfällen mit Sedativa, wodurch die Zuverlässigkeit einer klinischen Untersuchung herabsetzt wird, kann eine verlängerte Überwachung erforderlich sein [156].
Blutzuckereinstellung
Es besteht ein starker Zusammenhang zwischen hohen Blutzuckerwerten nach erfolgreicher Reanimation und einem schlechten neurologischen Outcome [13, 15, 20, 157–163]. Während eine randomisierte kontrollierte Studie auf einer kardiochirurgischen Intensivstation zeigte, dass eine enge Blutzuckereinstellung (4,4–6,1 mmol/l oder 80–110 mg/dl) durch den Einsatz von Insulin die innerklinische Mortalität bei kritisch kranken Erwachsenen reduziert, [164] zeigte eine zweite Studie derselben Arbeitsgruppe bei internistischen Intensivpatienten keinen Überlebensvorteil [165]. In einer randomisierten Studie an erfolgreich reanimierten Patienten nach OHCA mit initialem Kammerflimmern bewirkte eine strikte Blutzuckereinstellung (72–108 mg/dl, 4–6 mmol/l) keinen Überlebensvorteil im Vergleich zu einer moderaten Blutzuckereinstellung (108–144 mg/dl, 6–8 mmol/l), wobei es in der Gruppe mit strikter Blutzuckereinstellung zu mehr hypoglykämischen Episoden gekommen ist [166]. Eine großangelegte randomisierte Studie zur Auswirkung einer strengen (4,5–6 mmol/l) im Vergleich zu einer herkömmlichen Blutzuckereinstellung (≤ 10 mmol/l) an Intensivpatienten berichtete von einer angestiegenen 90-Tage-Mortalität in der Patientengruppe mit strenger Blutzuckereinstellung [167, 168]. Eine schwere Hypoglykämie wiederum ist assoziiert mit einer gesteigerten Mortalität bei kritisch kranken Paienten [169], wobei insbesondere bei Bewusstlosen das Risiko einer unerkannten Hypoglykämie besteht. Unabhängig vom Zielbereich sind schwankende Blutzuckerwerte mit einer erhöhten Mortalität verbunden [170]. Im Vergleich zu Normothermie geht die therapeutische milde Hypothermie mit höheren Blutzuckerwerten, mit stärkeren Schwankungen der Blutzuckerwerte und mit einem gesteigerten Insulinbedarf einher [171]. Stärkere Schwankungen der Blutzuckerwerte sind assoziiert mit einer erhöhten Mortalität und einem ungünstigen neurologischen Outcome nach Kreislaufstillstand [157, 171].
Auf der Grundlage der verfügbaren Daten soll nach ROSC der Blutzuckerwert auf ≤ 10 mmol/l (≤ 180 mg/dl) eingestellt werden. Das Auftreten von Hypoglykämien soll vermieden werden [172]. Aufgrund des erhöhten Hypoglykämierisikos wird eine strenge Blutzuckereinstellung bei Patienten mit ROSC nach einem Kreislaufstillstand nicht durchgeführt.
Temperaturkontrolle
Behandlung von Hyperthermie und Fieber
In den ersten 48 h nach einem Kreislaufstillstand wird häufig eine Periode mit Hyperthermie oder Fieber beobachtet [13, 173–176]. Mehrere Studien belegen einen Zusammenhang zwischen der Hyperthermie nach Reanimation und einer schlechten neurologischen Erholung [13, 173, 175–178]. Die Entwicklung einer Hyperthermie nach therapeutischer milder Hypothermie (Rebound-Hyperthermie) ist mit einer erhöhten Mortalität und schlechterer neurologischer Erholung assoziiert [179–182]. Bisher gibt es keine randomisierte kontrollierte Studie, welche die Auswirkungen einer Fieberbehandlung (definiert als ≥ 37,6 °C) im Vergleich zu nicht durchgeführter Temperaturkontrolle bei Patienten nach Kreislaufstillstand untersucht. Insofern ist es möglich, dass die Hyperthermie post reanimationem alleinig Ausdruck einer stärkeren ischämischen Schädigung des Gehirns ist.
Obwohl die Auswirkung der Hyperthermie nach Wiederbelebung auf das Reanimationsergebnis nicht zweifelsfrei bewiesen ist, scheint es angemessen zu sein, die Postreanimationshyperthermie mit Antipyretika zu behandeln oder eine aktive Kühlung bei bewusstlosen Patienten zu erwägen.
Zielgerichtetes Temperaturmanagement („Targeted Temperature Management“, TTM)
Daten von tierexperimentellen und klinischen Studien zeigen, dass eine milde Hypothermie – therapeutisch nach globaler zerebraler Hypoxie/Ischämie eingesetzt – neuroprotektiv ist und die Reanimationsergebnisse verbessert [183, 184]. Hierbei unterdrückt die Kühlung eine Vielzahl von Reaktionswegen, die zur Nekrose oder verzögertem Zelltod, auch Apoptose (programmierter Zelltod) genannt, führen. Hypothermie verringert die zerebrale metabolische Rate für Sauerstoff (CMRO2) um rund 6 % pro 1 °C Reduzierung der Körperkerntemperatur, was die Freisetzung von exzitatorischen Aminosäuren und freien Radikalen vermindern kann [183, 185]. Darüber hinaus blockiert die Hypothermie die intrazellulären Folgen der Exposition gegenüber erhöhter Calcium- und Glutamatkonzentrationen („excitotoxins“) und reduziert die entzündliche Reaktion des Postreanimationssyndroms. Ergänzend stellt eine aktuelle Studie fest, dass es im Temperaturbereich von 33−36 °C nach erfolgreicher Reanimation keinen Unterschied in der inflammatorischen Zytokinantwort bei erwachsenen Patienten gibt [186].
Alle bisherigen Studien zur milden induzierten Hypothermie nach Reanimation haben ausschließlich Patienten untersucht, welche nach Kreislaufwiederherstellung weiterhin komatös waren. Eine randomisierte und eine pseudorandomisierte Studie haben nachgewiesen, das eine therapeutische Hypothermie sowohl die Entlassungsrate als auch das neurologische Ergebnis bei Entlassung oder nach 6 Monaten verbessert, wenn komatöse Patienten nach einem prähospitalen Kreislaufstillstand und Kammerflimmern gekühlt wurden [187, 188]. In diesen Studien wurde die Kühlung innerhalb von Minuten bis Stunden nach ROSC eingeleitet und über einen Zeitraum von 12–24 h in einem Temperaturbereich von 32–34 °C gehalten.
Drei Kohortenstudien mit insgesamt 1034 Patienten haben die milde induzierte Hypothermie verglichen mit einer Behandlung ohne Temperaturmanagement nach prähospitalem Kreislaufstillstand und fanden keinen Unterschied in der neurologischen Erholung [adjustierte gepoolte Odds Ratio (OR), 0,90 (95 %-CI, 0,45–1,82)] [189–191]. Eine weitere retrospektive Registerstudie an 1830 Patienten dokumentiert eine Erhöhung der schlechten neurologischen Erholung bei Menschen mit nicht defibrillierbarem Kreislaufstillstand, welche mit milder induzierter Hypothermie behandelt wurden (adjustierte OR 1,44 [95 % CI, 1,039–2,006] [192]).
Es gibt zahlreiche Vorher-nachher-Studien zur Implementierung der Temperaturkontrolle nach intrahospitalem Kreislaufstillstand, welche aber extrem schwer zu interpretieren sind, da mit der Temperaturkontrolle auch andere Änderungen in der Postreanimationsbehandlung implementiert wurden. Eine retrospektive Kohortenstudie an 8316 Patienten, die einen Kreislaufstillstand im Krankenhaus (IHCA) erlitten hatten und Kammerflimmern, Asystolie oder eine EMD aufwiesen, zeigte keinen Unterschied im Überleben bis zur Krankenhausentlassung. Es wurden Patienten untersucht, die mit milder induzierter Hypothermie behandelt wurden, und verglichen mit den Patienten, die kein aktives Temperaturmanagement erhielten (OR 0,9, 95 %-CI 0,65–1,23). Einschränkend muss aber ergänzt werden, dass nur relativ wenige Patienten mit milder induzierter Hypothermie behandelt wurden [193].
In die Studie zum zielgerichteten Temperaturmanagement („Targeted Temperature Management Trial“, TTM) wurden 950 Patienten mit außerklinischem Kreislaufstillstand unabhängig vom initialen Herzrhythmus eingeschlossen. Diese Patienten erhielten ein 36-stündiges Temperaturmanagement entweder bei 33 oder bei 36 °C, wobei die Zieltemperatur 28 h lang aufrechterhalten wurde und eine Phase der langsamen Wiedererwärmung folgte [31]. Die Studie beinhaltete strenge Protokolle zur Bewertung der Prognose und für den Entzug der lebenserhaltenden Intensivbehandlung. Es ergab sich kein Unterschied für den primären Endpunkt – der Gesamtmortalität –, und auch das neurologische Ergebnis nach 6 Monaten war vergleichbar (Hazard Ratio, HR, für die Mortalität am Ende der Studie 1,06, 95 %-CI 0,89–1,28; relatives Risiko, RR, für den Tod oder ein schlechtes neurologische Ergebnis nach 6 Monaten 1,02, 95 %-CI 0,88–1,16). Ebenso war das differenzierte neurologische Ergebnis nach 6 Monaten vergleichbar [22, 24]. Wichtig ist der Hinweis, dass die Patienten in beiden Teilen der Studie ein so gutes Temperaturmanagement erhielten, dass Fieber in beiden Gruppen sicher verhindert wurde. TTM mit 33 °C bedingte im Vergleich zu TTM mit 36 °C eine verringerte Herzfrequenz, erhöhte Lactatwerte, eine verstärkte Vasopressorunterstützung und einen höheren SOFA-Score (Herz-Kreislauf) [101, 194]. Die Bradykardie, welche während der milden induzierten Hypothermie beobachtet wurde, kann vorteilhaft sein, da sie mit einem guten neurologischen Ergebnis bei komatösen Überlebenden nach prähospitalem Kreislaufstillstand assoziiert ist. Vermutlich ist die Bradykardie ein Hinweis auf den Erhalt autonomer Funktionen [118, 119].
Die optimale Anwendungsdauer für eine milde induzierte Hypothermie und ein TTM ist unbekannt, obwohl beide Verfahren derzeit am häufigsten für 24 h eingesetzt werden. Vorherige Studien behandelten die Patienten über 12−28 h mit TTM [31, 187, 188]. Zwei Beobachtungsstudien fanden keinen Unterschied in der Sterblichkeit oder ein schlechteres neurologisches Ergebnis bei 24 h im Vergleich mit 72 h Dauer der Hypothermie [195, 196]. Zu bemerken ist, dass in der TTM-Studie eine Normothermie von < 37,5 °C bis 72 h nach ROSC strikt eingehalten wurde [31].
Die Begriffe „zielgerichtetes Temperaturmanagement“ oder „Temperaturkontrolle“ sind gegenüber dem früher gebräuchlichen Begriff „therapeutische Hypothermie“ zu bevorzugen. Die Advanced Life Support Task Force des International Liaison Committee on Resuscitation erarbeitete zuvor mehrere Behandlungsempfehlungen zum zielgerichteten Temperaturmanagement, die in diesen ERC-Leitlinien 2015 reflektiert werden:
-
Eine konstante Zieltemperatur zwischen 32 und 36 °C soll für jene Patienten eingehalten werden, bei denen eine Temperaturkontrolle angewendet wird (starke Empfehlung, mäßige Qualität der Evidenz).
-
Ob bestimmte Subpopulationen von Patienten nach Kreislaufstillstand von niedrigeren (32–34 °C) oder höheren (36 °C) Temperaturen des TTM profitieren, bleibt unbekannt, und weitere Studien sind notwendig, dies zu klären.
-
TTM wird für erwachsene Patienten nach prähospitalem Kreislaufstillstand mit defibrillierbarem Rhythmus empfohlen, wenn der Patient nach ROSC weiterhin „nicht reagiert“ (starke Empfehlung, geringe Evidenz).
-
TTM wird für erwachsene Patienten nach prähospitalem Kreislaufstillstand mit nicht defibrillierbarem Rhythmus vorgeschlagen, wenn der Patient nach ROSC „nicht reagierend“ bleibt (schwache Empfehlung, sehr geringe Evidenz).
-
TTM wird für erwachsene Patienten nach innerklinischem Kreislaufstillstand unabhängig vom initialem Rhythmus vorgeschlagen, wenn der Patient nach ROSC „nicht reagierend“ bleibt (schwache Empfehlung, sehr geringe Evidenz).
-
Wenn ein zielgerichtetes Temperaturmanagement verwendet wird, wird vorgeschlagen, dass die TTM-Dauer mindestens 24 h beträgt (entsprechend der beiden größten bisherigen randomisierten klinischen Studien [31, 187]; schwache Empfehlung, sehr geringe Evidenz).
Es ist klar, dass die optimale Zieltemperatur für die Postreanimationsbehandlung derzeit nicht bekannt ist und dass mehr qualitativ hochwertige große Studien nötig sind, um die offenen Fragen zu klären [197].
Wann soll die Temperaturkontrolle beginnen?
Unabhängig davon, welche Zieltemperatur ausgewählt wird, sind Maßnahmen für eine aktive Temperaturregelung zu ergreifen, um die Temperatur im gewählten Zielbereich zu halten. Früher wurde empfohlen, dass die Kühlung so früh wie möglich nach ROSC begonnen werden soll. Diese Empfehlung aber basierte ausschließlich auf tierexperimentellen Daten und rationalen Vermutungen [198].
Tierexperimentelle Daten zeigen, das eine frühere Kühlung nach ROSC eine bessere Erholung bedingt [199, 200].
Die Interpretation von Beobachtungsstudien wird durch die Tatsache gestört, dass Patienten, die schneller spontan abkühlen, eine schlechtere neurologische Erholung zeigen [201–203]. Es wird angenommen, dass die Patienten mit schweren ischämischen Hirnschädigungen eher ihre Fähigkeit zur Steuerung der Körpertemperatur verlieren.
Fünf randomisierte kontrollierte Studien verwendeten kalte Infusionslösungen zur Hypothermieinduktion nach ROSC, [204–207] eine Studie untersuchte die Infusionstherapie mit kalter Flüssigkeit während der Reanimation, [208] und eine Studie an Patienten verwendete eine intranasale Kühlmethode während der Reanimation [209]. Das Volumen der Infusionstherapie betrug 20–30 ml/kg und bis zu 2 l, obwohl einige Patienten nicht die volle Infusionsmenge bis zur Ankunft im Krankenhaus erhielten. Alle 7 Studien sind in ihrer Aussage limitiert, da die Verblindung der klinischen Teams unvermeidbar unmöglich war und drei Studien zusätzlich auch die Untersucher des Reanimationsergebnisses nicht verblindeten.
Diese Studien zeigten keinen Unterschied in der Gesamtmortalität bei Patienten mit und ohne prähospitale Kühlung (RR, 0,98; 95 %-CI, 0,92–1,04). Keine einzelne Studie konnte einen Effekt der prähospitalen Kühlung auf die Mortalität oder eine schlechte neurologische Erholung feststellen. Vier randomisierte klinische Studien lieferten eine geringe Evidenz für ein erhöhtes Risiko eines erneuten Kreislaufstillstands durch die prähospital induzierte Hypothermie (RR 1,22; 95 %-CI, 1,01–1,46), [204, 205, 207] obwohl dieses Ergebnis im Wesentlichen von den Daten aus der größten Studie beeinflusst ist [207]. Drei Untersuchungen und zwei kleine Pilotstudien berichteten eine vergleichbare Inzidenz für ein Lungenödem in jeder Gruppe, [204, 208] und eine Studie zeigte eine Zunahme des Lungenödems bei Patienten, die eine präklinische Kühlung erhalten hatten (RR 1,34; 95 %-CI, 1,15–1,57) [207].
Auf der Grundlage dieser Evidenz kann die prähospitale Kühlung mittels einer schnellen i.v.-Infusion großer Mengen kalter Flüssigkeit unmittelbar nach ROSC nicht empfohlen werden. Es kann aber immer noch sinnvoll sein, kalte intravenöse Flüssigkeit zu infundieren, z. B. dann, wenn der Patient gut überwacht ist und eine Temperatur von 33 °C das Ziel ist. Andere prähospitale Kühlstrategien als die schnelle i.v.-Infusion großer Volumina kalter Flüssigkeit sind während der kardiopulmonalen Reanimation nicht ausreichend untersucht worden. Ob bestimmte Patientengruppen, z. B. bei überdurchschnittlich langer Transportzeit ins Krankenhaus, von einer prähospitalen Kühlstrategie profitieren könnten, ist unbekannt.
Wie soll die Temperatur kontrolliert werden?
Die praktische Anwendung des TTM ist in 3 Phasen unterteilt: Induktion, Aufrechterhaltung und Wiedererwärmung [210]. Externe und/oder interne Kühltechniken kommen im Rahmen des TTM zum Einsatz. Wenn eine Zieltemperatur von 36 °C gewählt wird, ist es für die vielen Postreanimationspatienten, die das Krankenhaus mit einer Temperatur von weniger als 36 °C erreichen, ein praktischer Ansatz, die spontane Erwärmung auf 36 °C abzuwarten und ein TTM-Gerät dann zu aktivieren, wenn die Patienten eine Körperkerntemperatur von 36 °C erreicht haben. Die Aufrechterhaltungsphase ist bei 36 °C die gleiche wie für andere hypotherme Zieltemperaturen; Kältezittern beispielsweise tritt bei Patienten mit 33 °C oder 36 °C gleichermaßen auf [31]. Wenn Sie eine Zieltemperatur von 36 °C gewählt haben, wird die Wiedererwärmungsphase kürzer sein.
Wenn eine niedrigere Zieltemperatur, z. B. 33 °C, gewählt wird, kann eine i.v.-Infusion von 30 ml/kg einer 4 °C kalten Kochsalz- oder Hartmann’s Lösung die Kerntemperatur um etwa 1–1,5 °C senken [206, 207, 211]. Es ist jedoch zu beachten, dass in einer präklinischen randomisierten kontrollierten Studie in einem Paramedic-System diese Intervention mit einer erhöhten Lungenödemrate assoziiert war (diagnostiziert mittels einer Röntgenaufnahme des Thorax zum Aufnahmezeitpunkt). Zusätzlich wurde eine erhöhte Re-Arrest-Rate während des Transports ins Krankenhaus berichtet [207].
Folgende Verfahren zur Induktion und/oder Aufrechterhaltung des TTM sind möglich:
-
Die Verwendung von Eisbeuteln und/oder nassen Handtüchern ist bezüglich des Materialaufwands kostengünstig; jedoch erhöht dieses Verfahren den Zeitaufwand für das Pflegepersonal, kann größere, unerwünschte Temperaturschwankungen zur Folge haben und erlaubt keine kontrollierte Wiedererwärmung [11, 19, 188, 212–219]. Um eine Hypothermie aufrechterhalten zu können, reicht die alleinige Infusion eiskalter Flüssigkeiten nicht aus [220]; die zusätzliche Verwendung von einfachen Eisbeuteln kann aber zu einer adäquaten Temperaturkontrolle führen [218].
-
Wasser- oder Luftzirkulationsdecken [7, 8, 10, 182, 226, 228–234].
-
Transnasale Verdunstungskühlung [209]. Diese Technik ermöglicht die Kühlung während der Reanimation noch vor ROSC. Sie wird aktuell in einer weiteren großen mulitizentrischen randomisierten Studie untersucht [239].
-
Intravaskuläre Wärmetauscher, welche in der Regel in die V. femoralis oder V. subclavia platziert werden [7, 8, 215, 216, 226, 228, 232, 240–245].
-
Extrakorporale Zirkulation (z. B. Herz-Lungen-Maschine, ECMO) [246, 247].
In den meisten Fällen ist es leicht, die Patienten nach ROSC zu kühlen, da die Körperkerntemperatur in den ersten Stunden normalerweise abfällt [13, 176]. Bei Krankenhausaufnahme nach prähospitalem Kreislaufstillstand liegt die Temperatur gewöhnlich zwischen 35 und 36 °C, und in einer aktuellen großen Untersuchung betrug die Temperatur im Median 35,3 °C [31]. Wenn also eine TTM-Zieltemperatur von 36 °C gewählt wurde, kann eine langsame passive Wiedererwärmung bis 36 °C erlaubt werden. Wenn aber eine TTM-Zieltemperatur von 33 °C gewählt wurde, so wird die initiale Kühlung durch die Applikation von Muskelrelaxanzien und Sedativa erleichtert, weil diese das Kältezittern verhindern [248]. Magnesiumsulfat, ein natürlich vorkommender NMDA-Rezeptor-Antagonist, kann zur Absenkung der Schwelle des Kältezitterns zusätzlich appliziert werden [210, 249].
In der Erhaltungsphase soll das Kühlverfahren bevorzugt verwendet werden, welches eine effektive Temperaturüberwachung ermöglicht und Temperaturschwankungen vermeidet. Dies geschieht am besten mit externen oder internen Kühlvorrichtungen, die mittels einer kontinuierlichen Temperaturrückkopplung die eingestellte TTM-Zieltemperatur exakt erreichen [250]. Die Körperkerntemperatur wird in der Regel von einem in der Blase und/oder dem Ösophagus platzierten Thermistor gemessen [210, 251, 252]. Noch liegen keine Daten vor, die anzeigen, dass eine spezifische Kühltechnik im Vergleich mit anderen Methoden die Überlebensrate erhöht; jedoch ermöglichen intern platzierte Wärmetauscher eine genauere Temperaturkontrolle als externe Kühlmethoden [226, 250].
Während der Induktionsphase und insbesondere der Wiedererwärmungsphase können sich die Plasmaelektrolytkonzentrationen, das intravaskuläre Volumen und die metabolische Rate des Stoffwechsels schnell ändern. Eine Rebound-Hyperthermie ist mit einer schlechteren neurologischen Erholung assoziiert [179, 180]. Aus diesen Gründen soll die Wiedererwärmung langsam erfolgen: Die optimale Rate ist nicht bekannt, der aktuelle Konsens aber empfiehlt eine Wiedererwärmungsrate von 0,25−0,5 °C pro Stunde [228]. Wurde eine TTM-Zieltemperatur von 36 °C gewählt, können die o. g. Risiken vermindert sein [31].
Physiologische Wirkungen und Nebenwirkungen von Hypothermie
Die allgemein bekannten physiologischen Wirkungen der Hypothermie müssen sorgfältig beachtet werden [210]:
-
Kältezittern erhöht den Metabolismus und die Wärmeproduktion, wodurch die zu erzielende Kühlrate vermindert wird. Insofern wurden schon weiter oben im Text Strategien diskutiert, welche das Kältezittern reduzieren können. Das Auftreten von Kältezittern bei Überlebenden nach Kreislaufstillstand, welche mit milder induzierter Hypothermie behandelt werden, ist mit einer guten neurologischen Erholung assoziiert [253, 254], da es ein Zeichen für eine normale physiologische Reaktion ist. Bei einer TTM-Zieltemperatur von 33 und 36 °C trat Kältezittern mit ähnlicher Wahrscheinlichkeit auf [31]. Ein Protokoll für die Analgosedierung ist erforderlich.
-
Milde induzierte Hypothermie steigert den systemischen Gefäßwiderstand und bewirkt Arrhythmien (üblicherweise Bradykardien) [241]. Wichtig ist hier der Hinweis, dass die Bradykardie – ausgelöst durch eine milde induzierte Hypothermie – vorteilhaft sein kann (ähnlich der Wirkung von Betablockern), da sie die diastolische Dysfunktion des Myokards reduziert [117] und das Auftreten der Bradykardie mit einer guten neurologischen Erholung assoziiert ist [118, 119].
-
Milde induzierte Hypothermie bewirkt eine Steigerung der Diurese und Elektrolytstörungen, wie Hypophosphatämie, Hypokaliämie, Hypomagnesiämie und Hypokalämie [31, 210, 255].
-
Hypothermie verringert die Insulinempfindlichkeit und die Insulinsekretion und führt zu einer Hyperglykämie [188], welche eine Behandlung mit Insulin erforderlich macht (s. Glukosekontrolle).
-
Milde induzierte Hypothermie beeinträchtigt die Blutgerinnung und kann möglicherweise Blutungen verstärken. Dieser Effekt scheint vernachlässigbar zu sein [256] und konnte in klinischen Studien nicht bestätigt werden [7, 31, 187]. In einer Registerstudie trat eine erhöhte Rate von geringfügigen Blutungen auf, wenn eine Koronarangiographie und die milde induzierte Hypothermie kombiniert angewendet wurden. Gleichzeitig aber war diese Kombination von Interventionen auch der beste Prädiktor für eine gute Erholung [20].
-
Hypothermie kann das Immunsystem beeinträchtigen und die Infektionsrate erhöhen [210, 217, 222]. Milde induzierte Hypothermie ist mit einer erhöhten Inzidenz von Pneumonien assoziiert [257, 258]; jedoch scheinen diese Befunde keine Auswirkungen auf die Überlebensrate zu haben. Obwohl die prophylaktische Antibiotikabehandlung nicht prospektiv untersucht worden ist, konnte in einer Beobachtungsstudie gezeigt werden, dass sie mit einer verringerten Pneumonieinzidenz einherging [259]. In einer weiteren Beobachtungsstudie mit 138 Patienten, welche nach prähospitalem Kreislaufstillstand auf einer Intensivstation aufgenommen wurden, war die frühe Gabe von Antibiotika mit einer verbesserten Überlebensrate verknüpft [260].
-
Die Serum-Amylase-Konzentration ist üblicherweise während der Hypothermie erhöht; die Bedeutung dieses Befunds ist aber unklar.
-
Die Clearance von Sedativa und Muskelrelaxanzien ist bei einer Körperkerntemperatur von 34 °C um bis zu 30 % vermindert [261]. Die Clearance dieser und anderer Medikamente wird sich der normalen Clearance annähern, wenn die Temperatur näher bei 37 °C ist.
Kontraindikationen für das zielgerichtete Temperaturmanagement
Allgemein anerkannte Kontraindikationen für ein TTM bei 33 °C, welche aber nicht universell umgesetzt werden, umfassen schwere systemische Infektionen und eine bereits bestehende medizinische Koagulopathie. Zu beachten ist, dass die fibrinolytische Therapie keine Kontraindikation für eine milde induzierte Hypothermie ist.
Zwei Beobachtungsstudien dokumentierten eine positive inotrope Wirkung der milden induzierten Hypothermie bei Patienten im kardiogenen Schock, [262, 263] in der TTM-Studie gab es aber keinen Unterschied in der Sterblichkeit der Patienten, die mit leichtem Schock im Krankenhaus aufgenommen und entweder mit einer Zieltemperatur von 33 °C oder 36 °C behandelt wurden [194]. Tierexperimentelle Daten zeigen ebenso eine verbesserte kontraktile Funktion unter einer milden induzierten Hypothermie, welche wahrscheinlich auf einer erhöhten Ca2+-Sensititvität der Myofibrillen beruht [264]. Der kardiogene Schock stellt somit keine Kontraindikation für ein TTM dar.
Andere Therapien
Für neuroprotektive Medikamente (Coenzym Q10, [223] Thiopental, [153] Glukokorticoide, [123, 265] Nimodipin, [266, 267] Lidoflazin [268] oder Diazepam [154]) – alleinig oder als Ergänzung zu einer milden induzierten Hypothermie angewendet – konnte nicht gezeigt werden, dass sie die Rate neurologisch intakten Überlebens steigern, wenn sie in der Postreanimationstherapie angewendet wurden. Die Kombination aus einer Xenon-Applikation und der milden induzierten Hypothermie wurde in einer Machbarkeitsstudie untersucht und wird derzeit in weiteren klinischen Studien evaluiert [269].
Prognoseerstellung
Dieser Abschnitt wurde auf Basis des „Advisory Statement on Neurological Prognostication in comatose survivors of cardiac arrest“ [270] von den Mitgliedern der ERC-ALS-Arbeitsgruppe und der Sektion „Trauma and Emergency Medicine (TEM) of the European Society of Intensive Care Medicine (ESICM)“ adaptiert und im Vorgriff auf die Leitlinien von 2015 formuliert.
Eine hypoxisch-ischämische Hirnschädigung ist nach Reanimation und Kreislaufstillstand ein häufiges Problem [271]. Zwei Drittel der Patienten, die nach prähospitalem Kreislaufstillstand und Reanimation lebend auf eine Intensivstation aufgenommen werden konnten, sterben an einer neurologischen Schädigung des Gehirns. Dies wurde sowohl vor [28] wie auch nach [27, 30, 31] Einführung eines zielgerichteten TTM für die Postreanimationsbehandlung festgestellt. Die meisten dieser Todesfälle sind bedingt durch eine Entscheidung zum aktiven Entzug der lebenserhaltenden Behandlung (WLST), welche auf der Prognose einer schlechten neurologischen Erholung basiert [27, 30]. Aus diesem Grund ist es für die Prognosestellung bei komatösen Patienten nach Reanimation und Kreislaufstillstand essenziell, das Riskio einer falsch-pessimistischen Vorhersage zu minimieren. Im Idealfall soll die falsch-positive Rate (FPR) gleich null mit einem möglichst schmalen Konfidenzintervall (CI) sein, wenn eine schlechte neurologische Prognose erstellt wurde. Die meisten Studien zur Prognoseerstellung umfassen jedoch so wenige Patienten, dass selbst dann, wenn die FPR = 0 ist, die obere Grenze des 95 %-CI meist sehr hoch liegt [272, 273]. Darüber hinaus sind viele Studien dadurch schwer zu interpretieren, dass – im Sinne einer sich selbst erfüllenden Prophezeiung – der behandelnde Arzt selbst die Prognose erstellt und im Falle einer schlechten Prognose die WLST durchführt, was zum Tode führt und die schlechte Prognose bestätigt [272, 274]. Abschließend muss festgestellt werden, dass Sedativa und Muskelrelaxanzien, aber auch eine TTM mit verschiedenen Prognose-Indizes interferrieren können, insbesondere dann, wenn diese auf klinischen Untersuchungen basieren [156].
Klinische Untersuchung
Bilaterale Abwesenheit des Pupillenlichtreflexes – festgestellt 72 h nach ROSC – prognostiziert eine schlechte neurologische Erholung nahe bei 0 % FPR, dies sowohl in TTM- als auch in nicht-TTM-behandelten Patienten [FPR = 1 % (0–3) und 0 % (0–8)] [156, 275–284], und weist eine relativ geringe Sensitivität (19 % bzw. 18 %) auf. Eine ähnliche Statistik wurde für die bilaterale Abwesenheit des Kornealreflexes dokumentiert [272, 273].
In Patienten ohne TTM-Behandlung [276, 285] zeigte sich, dass die Abwesenheit einer motorischen Reaktion oder Strecksynergismen als Antwort auf einen Schmerzreiz – untersucht 72 h nach ROSC – eine hohe Sensitivität [74 (68–79)%] zur Vorhersage einer schlechten neurologischen Erholung aufweist. Einschränkend muss festgestellt werden, dass die FPR ebenfalls hoch ist [27 (12–48)%]. Ähnliche Ergebnisse wurden bei Patienten mit TTM-Behandlung beobachtet [156, 277–280, 282–284, 286–288]. Dennoch kann die hohe Sensitivität der o. g. pathologischen mototrischen Reaktion verwendet werden, um die Population von Patienten mit einer möglichen schlechten neurologischen Prognose zu identifizieren, um mit weiteren Untersuchungen eine bessere Prognoseerstellung zu erzielen. Cave: Wie der Kornealreflex kann auch die motorische Reaktion durch Sedativa oder Muskelrelaxanzien unterdrückt sein [156]. Wenn ein Überhang von Analgosedierung oder Muskelerelaxation nicht ausgeschlossen werden kann, so ist das Beobachtungsintervall über die 72 h ab ROSC hinaus zu verlängern, um das Risiko von falsch-positiven Ergebnissen zu minimieren.
Der Myoklonus ist ein klinisches Phänomen, bestehend aus plötzlichen, kurzen, unwillkürlichen Zuckungen, verursacht durch Kontraktionen an lokalen Muskelgruppen, multifokal oder generalisiert. Sind generalisierte Myoklonien über einen längeren Zeitraum kontinuierlich zu beobachten, wird dies im Allgemeinen als Status myoclonus beschrieben. Zwar gibt es keine endgültige Einigung darüber, wie lange oder wie häufig Myoklonien auftreten müssen, um als solche qualifiziert zu werden, in Prognosestudien bei komatös überlebenden Patienten nach Kreislaufstillstand aber wurde eine Mindestdauer von 30 min berichtet. Jedoch differiert die Definition eines Status myoclonus von Studie zu Studie.
Während das Auftreten von Myoklonien in komatösen Überlebenden nach Kreislaufstillstand nicht sicher mit einer schlechten neurologischen Erholung assoziiert ist (FPR 9 %) [145, 272], ist ein Status myoclonus, der innerhalb von 48 h nach ROSC erstmalig beobachtet wird, sicher mit einer solchen vergesellschaftet [FPR 0 (0–5)%; sensitivity 8 %]. Dies konnte in Prognosestudien bei Patienten ohne TTM-Behandlung gezeigt werden [276, 289, 290] und ist auch hoch prädiktiv bei Patienten mit TTM-Behandlung [FPR 0 % (0–4); Sensitivität 16 %] [144, 156, 291]. Mittlerweile sind jedoch mehrere Fallberichte publiziert worden, die von einer guten neurologischen Erholung berichten, obwohl frühzeitig lang andauernde und generalisierte Myoklonien beobachtet wurden. In einigen dieser Fälle persistierte die Myoklonie auch nach dem Erwachen des Patienten und ging in chronische, aktivitätsgetriggerte Myokloni über (Lance-Adams-Syndrom) [292–297]. Bei anderen Patienten verschwanden sie mit Wiedererlangung des Bewusstseins [298, 299]. Der exakte Zeitpunkt, wann diese Patienten ihr Bewusstsein wiederverlangten, kann durch die Myoklonie oder die Sedierung maskiert gewesen sein. Aus diesen Gründen sollen Patienten mit einem Status myoclonus post reanimationem – wann immer möglich – ohne Einfluss einer Sedierung untersucht werden; bei diesen Patienten können EEG-Aufzeichnungen hilfreich sein, um EEG-Anzeichen von Bewusstsein und Reaktionsfähigkeit des zentralen Nervensystems oder aber epileptiforme EEG-Aktivität zu detektieren.
Prädiktoren für eine schlechte neurologische Erholung auf der Basis einer klinischen Untersuchung sind zwar preiswert und einfach zu erheben, jedoch ist es nachteilig, dass diese Untersuchungsergebnisse nicht vor dem Behandlungsteam verborgen werden können und somit – möglicherweise – das klinische Management beeinflussen und zu einer sich selbst erfüllenden Prophezeiung führen. Klinische Studien sind notwendig, um die Reproduzierbarkeit der klinischen Prädiktoren hinsichtlich der Prognoseerstellung bei komatösen Postreanimationspatienten zu evaluieren.
Elektrophysiologie
Frühe somatosensorisch evozierte Potenziale (SSEPs)
In komatösen Postreanimationspatienten ohne TTM-Behandlung kann das bilaterale Fehlen der N20-Antwort im SSEP Tod oder Wachkoma (CPC 4–5) mit einer FPR von 0 (0–3)% schon 24 h nach ROSC vorhersagen [276, 300, 301]. Dieser Befund bleibt für die nächsten 48 h prädiktiv mit einer konsistenten Sensitivität (45–46 %) [276, 300, 302–304]. Unter insgesamt 287 Patienten mit fehlendem N20-SSEP-Frühpotenzial innerhalb von 72 h nach ROSC gab es nur ein falsch-positives Resultat (positiver prädiktiver Wert 99,7 [98–100]%) [305].
In Patienten mit TTM-Behandlung ist das bilaterale Fehlen der N20-SSEP-Antwort ebenso ein akkurater Prädiktor einer schlechten neurologischen Erholung sowohl während der milden induzierten Hypothermie [278, 279, 301, 306] [FPR 2 (0–4)%] als auch nach Wiedererwärmung [277, 278, 286, 288, 304] [FPR 1 (0–3)%]. Die geringe Anzahl falscher Prognosen, welche in großen Patientenkohorten beobachtet wurden, sind hauptsächlich auf Artefakte zurückzuführen [279, 284]. Die Ableitung der SSEPs erfordert eine angemessene Übung und Erfahrung des Untersuchers. Zudem ist äußerste Vorsicht geboten, um elektrische Störungen durch Muskelartefakte oder durch die ICU-Umgebung zu vermeiden. Die Interobserverübereinstimmung für die SSEP-Untersuchung bei anoxisch-ischämischem Koma ist mäßig bis gut und wird durch Rauschen beeinflusst [307, 308].
In den meisten Prognosestudien wurde die bilaterale Abwesenheit des N20-SSEP-Frühpotenzials als ein Entscheidungskriterium für den Entzug der lebenserhaltenden Behandlung herangezogen; dies birgt die Gefahr der sich selbst erfüllenden Prophezeihung [272]. Ergebnisse der SSEP-Untersuchung beeinflussen Ärzte und Familien eher als die der klinischen Untersuchung oder des EEG, eine lebenserhaltende Behandlung zu beenden (WLST) [309].
Elektroenzephalographie
Das Fehlen der EEG-Reaktivität
In Patienten mit TTM-Behandlung prognostiziert das Fehlen der EEG-Reaktivität eine schlechte neurologische Erholung mit einer FPR = 2 (1–7)% während der Hypothermie [288, 310, 311] und mit einer FPR = 0 (0–3)% nach der Wiedererwärmung 48–72 h nach ROSC [286, 288, 310].
Die Limitationen dieser Methode ergeben sich aus folgenden Befunden: In einer Prognosestudie bei posthypoxischem Myoklonus zeigten 3 Patienten ohne EEG-Reaktivität nach TTM-Behandlung eine gute neurologische Erholung [144]. Die meisten der Prognosestudien zu fehlender EEG-Reaktivität nach Kreislaufstillstand sind aus derselben Forschungsgruppe. Weitere Einschränkungen der EEG-Reaktivitätsuntersuchung betreffen den Mangel an Standardisierung der Stimulationsmodalität und die bescheidene Urteilsübereinstimmung [312].
Status epilepticus
In Patienten mit TTM-Behandlung ist ein Status epilepticus (SE), d. h. eine längere epileptiforme Aktivität, während therapeutischer Hypothermie oder unmittelbar nach der Wiedererwärmung [150, 291, 313] fast immer – aber nicht immer – mit einer schlechten neurologischen Erholung assoziiert (FPR von 0−6 %), insbesondere dann, wenn das EEG keine Reaktivität zeigt [150, 314] oder die EEG-Hintergrundaktivität diskontinuierlich ist [75]. Limitationen: Alle Studien über den SE beruhen auf einer nur geringen Patientenzahl; zudem sind die Definitionen des SE in diesen Studien inkonsistent.
Burst-suppression-EEG
Burst-Suppression wurde erst kürzlich definiert als eine EEG-Aufzeichnung, bei der mehr als 50 % der EEG-Perioden eine Spannung < 10 µV aufweisen und sich mit EEG-Bursts abwechseln [148]. Jedoch haben die meisten EEG-Prognosestudien nicht mit dieser Definition gearbeitet. In komatösen Überlebenden nach Kreislaufstillstand mit und ohne TTM-Behandlung ist das Burst-suppression-EEG in der Regel ein vorübergehender Befund. Während der ersten 24–48 h nach ROSC [305] in nicht-TTM-behandelten Patienten oder während der Hypothermie bei TTM-behandelten Patienten [288, 306, 315] ist ein Burst-suppression-EEG kompatibel mit einer guten neurologischen Erholung. Persistiert es aber über 72 h nach ROSC hinaus, [75, 276, 316], so ist dies durchgehend mit einer schlechten Prognose assoziiert. Limitierte Daten deuten darauf hin, dass bestimmte EEG-Muster, wie z. B. eines von identischen EEG-Bursts [317] oder die Assoziation eines Burst-suppression-EEG mit einem Status epilepticus [75], eine sehr hohe Spezifität aufweisen, eine schlechte neurologische Erholung vorherzusagen.
Abgesehen von seiner prognostischen Bedeutung ist die EEG-Überwachung oder -Aufzeichnung – entweder kontinuierlich oder intermittierend – in komatösen Überlebenden nach Kreislaufstillstand sowohl während der Hypothermie als auch nach Wiedererwärmung hilfreich, um den Erholungsgrad des Bewusstseins zu bewerten, welcher durch Analgosedierung, Muskelrelaxation, neuromuskuläre Funktionsstörung oder Myoklonus maskiert werden kann. Zudem ist es wichtig, nicht konvulsive epileptiforme Anfälle [318], die in etwa einem Viertel der komatösen Überlebenden nach Reanimation [75, 149, 291] auftreten, zu detektieren, um sie behandeln zu können.
Biomarker
Die neuronenspezifische Enolase (NSE) und S-100B sind Protein-Biomarker, die nach einer Verletzung von Neuronen und Gliazellen freigesetzt werden. Ihre Serumkonzentrationen korrelieren aller Wahrscheinlichkeit nach mit dem Ausmaß der anoxisch-ischämischen neurologischen Verletzungen und deshalb auch mit dem der möglichen neurologischen Erholung. Diesbezüglich ist S-100B weniger gut dokumentiert als NSE [319]. Biomarker als Prognoseinstrument haben gegenüber der EEG- und klinischen Untersuchung den Vorteil, dass deren Untersuchung quantitative Ergebnisse liefert und wahrscheinlich unabhängig von einer Analgosedierung beurteilt werden kann. Die Hauptlimitation der Biomarker zur Prognose liegt darin, Schwellenwerte zu definieren, welche Patienten identifiziert, die mit einem hohen Maß an Sicherheit nur eine schlechte neurologische Erholung aufweisen werden. In der Tat sind die Serumkonzentrationen von Biomarkern kontinuierliche Variablen, die somit in ihrer Anwendbarkeit zur Vorhersage eines dichotomischen Ergebnisses begrenzt sind, insbesondere dann, wenn ein Schwellenwert für 0 % FPR gefordert wird.
Neuronenspezifische Enolase (NSE)
In Patienten ohne TTM-Behandlung betrug der NSE-Schwellenwert – gemessen 24–72 h ab ROSC – zur Vorhersage einer schlechten neurologischen Erholung mit 0 % FPR 33 µg/l oder weniger. In einigen anderen Studien [276, 320, 321] konnte aber ein Schwellenwert von 47,6 µg/l nach 24 h, 65,0 µg/l nach 48 h und 90,9 µg/l nach 72 h – jeweils nach ROSC – festgestellt werden [302].
In Patienten, die eine TTM-Behandlung erhielten, variierte die NSE-Schwellenkonzentration für 0 % FPR zwischen 49,6 und 151,4 µg/l bei 24 h [313, 322–326], zwischen 25 und 151,5 µg/l nach 48 h [279, 313, 322–329] und zwischen 57,2 und 78,9 µg/l nach 72 h [321, 324, 327].
Die wichtigsten Gründe für die beobachtete Variabilität der NSE-Schwellenwerte liegen in der Verwendung von heterogenen Messtechniken (Variation zwischen verschiedenen Analysatoren) [330–332], der Anwesenheit von extraneuronalen Quellen von Biomarkern (Hämolyse und neuroendokrine Tumoren) [333] und der unvollständigen Kenntnisse über die Kinetik der Blutkonzentrationen in den ersten Tagen nach ROSC. Limitierte Evidenz legt den Verdacht nahe, dass der NSE-Schwellenwert nach 48–72 h höher liegt als nach 24 h [323, 325, 334]. Ansteigende NSE-Serumkonzentrationen im Zeitverlauf können eine zusätzliche Information für eine schlechte neurologische Erholung sein [323, 324, 334]. In einer Sekundäranalyse der TTM-Studie wurden die NSE-Serumkonzentrationen nach 24, 48 und 72 h bei 686 Patienten gemessen. Eine Erhöhung der NSE-Werte zwischen zwei beliebigen Zeitpunkten war mit einem schlechten neurologischen Ergebnis assoziiert [335].
Bildgebung
Hirn-CT
Der Haupt-CT-Befund der globalen anoxisch-ischämischen zerebralen Läsion nach Reanimation und Kreislaufstillstand ist das Hirnödem, [133] dieses zeigt sich als eine Verringerung der Tiefe der zerebralen Sulci (Sulci-Auslöschung) sowie in einer Aufhebung der Abgrenzug zwischen grauer und weißer Substanz aufgrund einer verringerten Dichte der grauen Substanz. Diese wird quantitativ als das Röntgendichteverhältnis (GWR) zwischen grauer und weißer Substanz gemessen. Die GWR-Schwelle zur Vorhersage einer schlechten neurologischen Erholung mit 0 % FPR lag in entsprechenden Prognosestudien zwischen 1,10 und 1,22 [281, 325, 336]. Einschränkend muss aber darauf hingewiesen werden, dass die Methoden zur Berechnung des Röntgendichteverhältnisses zwischen den Studien inkonsistent waren.
Magnetresonanztomographie – MRT („Magnetic Resonance Imaging“, MRI)
MRT-Veränderungen nach globaler anoxisch-ischämischer Hirnverletzung nach Reanimation und Kreislaufstillstand zeigen sich als Hyperintensitäten in kortikalen Arealen oder den Basalganglien in einer diffusionsgewichteten Bildgebungssequenz (DWI). In zwei kleineren Studien [337, 338] war das Vorhandensein von großen multilobären Pathologien in der DWI oder FLAIR-MRT-Bildgebung innerhalb des ersten von 5 Tagen nach ROSC konsistent mit einer schlechten neurologischen Prognose assoziiert, während kleine und fokale Läsionen dies nicht waren [329].
Der apparente (scheinbare) Diffusionskoeffizient (ADC) ist ein quantitatives Maß der diffusionsgewichteten Bildgebung (DWI). ADC-Werte zwischen 700 und 800 × 10−6 mm2/s werden als normale Werte für die graue Hirnsubstanz angesehen [339]. Bei Gehirn-ADC-Messungen zur Prognoseerstellung wurden entweder ADC-Werte für das ganze Gehirn [340] verwendet oder der Anteil des Hirnvolumens mit pathologisch niedrigen ADC-Werten quantitativ ausgewertet [341] oder aber die niedrigsten ADC-Werte in bestimmten Gehirnarealen, wie dem okzipitalen Kortex oder dem Putamen, bestimmt [322, 342]. Entsprechend variieren die ADC-Schwellenwerte, die einer 0 %-FPR zugeordnet werden können, zwischen den Untersuchungen. Eine weitere Limitation ergibt sich aus der Tatsache, dass diese Verfahren z. T. auf subjektiven menschlichen Entscheidungen bei der Identifizierung der interessierenden Regionen oder der Interpretation der Ergebnisse beruhen, obwohl kürzlich automatisierte Analysen vorgeschlagen wurden [343].
Die Vorteile der MRT- gegenüber der CT-Untersuchung des Gehirns liegen in der besseren räumlichen Definition und insbesondere in der höheren Empfindlichkeit bei der Detektierung ischämischer Läsionen. Die MRT-Untersuchung kann jedoch bei klinisch instabilen Patienten schwieriger in der Durchführung sein [339]. Einige Untersuchungen zeigten, das die MRT-Untersuchung umfangreiche pathologische Befunde liefern konnte, obwohl SSEP oder okulare Reflexe normal waren [329, 339].
Alle Studien zur Prognoseerstellung nach Reanimation und Kreislaufstillstand, welche auf einer apparativen Bildgebung basieren, wiesen jeweils nur eine kleine Stichprobengröße auf − mit einer daraus folgenden geringen Präzision und einer sehr geringen Qualität der Evidenz. Die meisten dieser Studien sind retrospektiv, und die Indikation zur CT- oder MRT-Untersuchung des Gehirns lag im Ermessen des behandelnden Arztes, der somit einen Selektionsbias mit einer möglichen Überschätzung der Aussagekraft verursacht.
Empfohlene Strategie zur Prognoseerstellung
Eine sorgfältige klinisch-neurologische Untersuchung bleibt die Grundlage der Prognoseerstellung des komatösen Patienten nach Kreislaufstillstand [344]. Sie soll täglich durchgeführt werden. Zu achten ist auf Anzeichen einer neurologischen Erholung, wie z. B. die Wiederkehr von gezielten Bewegungen, oder aber darauf, ob sich ein Krankheitsbild entwickelt, was darauf hindeutet, dass der Hirntod eingetreten ist.
Der Prozess der neurologischen Erholung nach globaler anoxisch-ischämischer Läsion ist in den meisten Patienten 72 h nach Kreislaufstillstand abgeschlossen [290, 345]. Jedoch ist darauf hinzuweisen, dass die Verlässlichkeit der neurologischen Untersuchung 72 h nach ROSC bei Patienten, die eine Analgosedierung innerhalb der vorangegangenen 12 h vor dieser Untersuchung erhalten haben, vermindert ist [156]. Bevor eine die Prognose bestimmende Untersuchung durchgeführt wird, müssen die wichtigen Störfaktoren ausgeschlossen sein [346, 347]. Neben der Analgosedierung und der neuromuskulären Blockade gehören dazu Hypothermie, schwere Hypotonie, Hypoglykämie sowie metabolische und respiratorische Störungen. Die Applikation von Analgetika, Sedativa und Muskelrelaxanzien muss lange genug beendet sein, um eine Beeinflussung der klinisch-neurologischen Untersuchung sicher zu vermeiden. Aus diesem Grund sollen kurz wirksame Medikamente bevorzugt angewendet werden. Wird ein Überhang der Analgosedierung oder Muskelrelaxation vermutet, sollen Antidota appliziert werden, um die Wirkung der Medikamente vor einer Untersuchung zu reversieren.
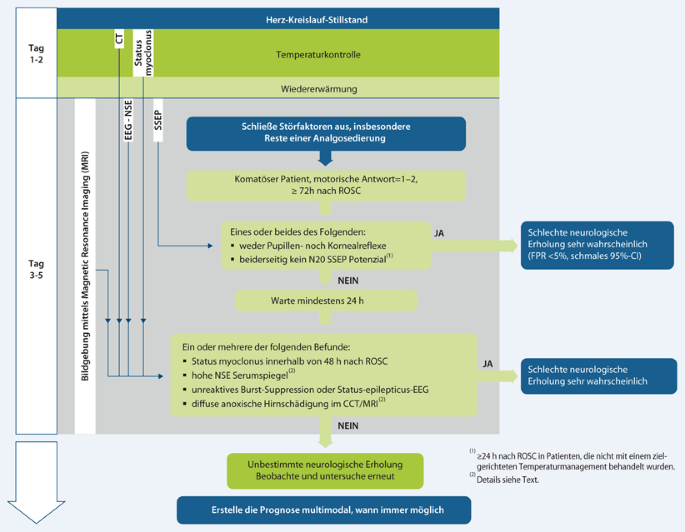
Der Algorithmus zur Prognosestrategie (Abb. 2) ist bei allen Patienten anwendbar, die nach mehr als 72 h weiterhin komatös sind und auf Schmerzreiz keine motorische Antwort oder Strecksynergismen zeigen. Bei der Gesamtbeurteilung zu diesem Zeitpunkt werden die Ergebnisse früherer prognostischer Tests mit einbezogen.
Zunächst sollen die robustesten Prädiktoren untersucht und bewertet werden. Diese weisen die höchste Spezifität und Genauigkeit auf (FPR < 5 % mit 95 %-CI < 5 % bei Patienten mit TTM-Behandlung) und wurden in mehr als 5 Studien von mehr als 3 Forschungsgruppen dokumentiert. Zu diesen robustesten Prädiktoren gehören bilateral fehlende Pupillenreflexe, festgestellt frühestens 72 h nach ROSC und bilateral fehlende N20-SSEP-Frühpotenziale nach Wiedererwärmung (letzterer Prädiktor kann schon früher – z. B. ≥ 24 h nach ROSC – erfasst werden, wenn die Patienten keiner TTM-Behandlung unterlagen). Basierend auf Expertenmeinungen, empfehlen wir, die Befunde zu fehlenden Pupillen- und Kornealreflexen gemeinsam hinsichtlich der Prognose einer schlechten neurologischen Erholung zu werten. Okularreflexe und SSEP behalten ihre Vorhersagewerte unabhängig von der gewählten Zieltemperatur bei TTM-Behandlung [283, 284].
Wenn keiner der oben genannten Prädiktoren für eine schlechte neurologische Prognose vorhanden ist, kann eine Gruppe von weniger genauen Prädiktoren evaluiert werden, deren Vorhersagepräzision aber geringer ist. Diese Prädiktoren weisen ebenfalls eine FPR < 5 % auf, das 95 %-CI ist aber breiter als bei den zuerst benannten Prädiktoren. Zudem sind Definition und/oder Schwelle in den verschiedenen Prognosestudien unterschiedlich. Zu diesen Prognosefaktoren gehören:
-
das Vorhandensein eines frühen Status myoclonus (innerhalb von 48 h nach ROSC),
-
hohe Serumkonzentrationen der NSE, gemessen 48–72 h nach ROSC,
-
ein unreaktives EEG und maligne EEG-Muster (Burst-suppression, Status epilepticus) nach Wiedererwärmung,
-
eine deutliche Reduzierung des Röntgendichteverhältnisses (GWR) zwischen grauer und weißer Hirnsubstanz oder Furchenauslöschung im Gehirn-CT innerhalb von 24 h nach ROSC oder
-
das Vorhandensein von diffusen ischämischen Veränderungen im MRT des Gehirns 2–5 Tage nach ROSC.
Basierend auf Expertenmeinungen, empfehlen wir eine Wartezeit von mindestens 24 h nach der ersten Prognoseerstellung und eine Bestätigung der Bewusstlosigkeit – ermittelt als ein Glasgow-Motor-Score von 1 bis 2 –, bevor Sie diese zweite Gruppe von Prädiktoren verwenden. Wir schlagen vor, dass mindestens zwei dieser Prädiktoren für die Prognoseerstellung herangezogen werden müssen.
Derzeit kann für die Serumkonzentration der NSE kein Schwellenwert zur Vorhersage einer schlechten neurologischen Prognose mit einer FPR von 0 % definiert werden. Im Idealfall wird jedes Krankenhauslabor, welches die NSE bestimmt, eigene Normal- und Schwellenwerte – basierend auf dem verwendeten Test-Kit – definieren müssen. Zusätzlich wird empfohlen, Proben zu mehreren Zeitpunkten zu entnehmen, um zeitliche Trends in der NSE-Serumkonzentration erfassen zu können und somit das Risiko von falsch-positiven Resultaten reduzieren zu können [335]. Es ist streng darauf zu achten, dass eine Hämolyse bei der Probeentnahme für die NSE-Bestimmung zu vermeiden ist.
Obwohl die robustesten Prädiktoren in den meisten Studien keine falsch-positiven Resultate zeigen, kann kein einzelner eine schlechte neurologische Erholung mit absoluter Sicherheit vorhersagen, wenn man die entsprechend umfassende Evidenz betrachtet. Darüber hinaus wurden diese Prädiktoren oft für den Entzug der lebenserhaltenden Therapie (WLST-Entscheidungen) verwendet, womit das Risiko einer sich selbst erfüllenden Prophezeiung verknüpft ist. Aus diesem Grund kann nur eine multimodale Prognoseerstellung empfohlen werden, die – wann immer möglich – auch in Gegenwart von einem dieser Prädiktoren, durchgeführt werden soll. Diese Strategie des multimodalen Ansatzes für die Prognoseerstellung erhöht die Sicherheit und steigert die Sensitivität [286, 311, 325, 348].
Wenn eine prolongierte Analgosedierung und/oder Muskelrelaxierung notwendig ist, z. B. um eine schwere respiratorische Insuffizienz zu behandeln, so empfehlen wir, die Untersuchungen zur Prognoseerstellung zu verschieben, bis eine verlässliche klinisch-neurologische Untersuchung durchgeführt werden kann. In diesem Zusammenhang gewinnen Biomarker, SSEPs und bildgebende Verfahren an Bedeutung, da diese unbeeinflusst von einer Medikamentenwirkung sind.
Bleibt trotz dieser Untersuchungen die Prognose unklar, sollen Ärzte einen längeren Beobachtungszeitraum nutzen. Ein Fehlen der klinischen Verbesserung im Laufe der Zeit deutet auf eine schlechtere neurologische Erholung hin. Obwohl ein Erwachen aus dem Koma bis zu 25 Tage nach Reanimation und Kreislaufstillstand beschrieben wurde [291, 298, 349], erlangen die meisten Überlebenden das Bewusstsein innerhalb 1 Woche wieder [31, 329, 350–352]. In einer aktuellen Beobachtungsstudie [351] erwachten 94 % der Patienten innerhalb von 4,5 Tagen nach Wiedererwärmung, und die restlichen 6 % erwachten innerhalb von 10 Tagen. Selbst diejenigen Patienten, die spät erwachten, können immer noch eine gute neurologische Erholung erreichen [351].
Rehabilitation
Obwohl die neurologische Erholung für die meisten Überlebenden eines Kreislaufstillstands als gut bewertet wird, sind kognitive und emotionale Probleme sowie ein Erschöpfungssyndrom (Fatigue) häufig [23, 24, 279, 353–356]. Langfristige kognitive Beeinträchtigungen werden bei der Hälfte der Überlebenden festgestellt [21, 22, 357, 358]. Hierbei ist am häufigsten das Gedächtnis betroffen, gefolgt von Problemen mit Aufmerksamkeit und Exekutivfunktionen (Planung und Organisation) [23, 359]. Die kognitiven Beeinträchtigungen können schwerwiegend sein, werden aber meist nur als mild beschrieben [22]. In einer Studie mit 796 Überlebenden eines prähospitalen Kreislaufstillstands konnten 76,6 % wieder eine Arbeit aufnehmen [360]. Diese leichten kognitiven Probleme werden häufig vom medizinischen Fachpersonal nicht erkannt und können nicht mit Standardergebnis-Skalen wie den „Cerebral Performance Categories“ (CPC) oder der „Mini-Mental State Examination“ (MMSE) nachgewiesen werden [24, 361]. Emotionale Probleme, darunter Depressionen, Angststörungen und posttraumatische Belastungsstörungen sind häufig [362, 363]. Eine Depression findet sich bei 14–45 % der Überlebenden, Angststörung bei 13–61 %, und Symptome der posttraumatischen Belastungsstörung treten bei 19–27 % auf [355]. Ein Fatigue-Syndrom wird von Überlebenden eines Kreislaufstillstands oft berichtet. Auch mehrere Jahre nach dem Ereignis leiden 56 % der Überlebenden teils unter einem schweren Fatigue-Syndrom [356].
Nicht nur die Patienten berichten über Probleme, sondern auch ihre Lebenspartner und Betreuer können sich stark belastet fühlen und haben oft emotionale Probleme, einschließlich einer posttraumatischen Belastungsstörung [356, 364]. Nach der Entlassung aus dem Krankenhaus berichten sowohl die Überlebenden als auch deren Betreuer über einen Mangel an Informationen über wichtige Themen wie den Umgang mit körperlichen und emotionalen Herausforderungen, implantierbare Kardioverter-Defibrillatoren (ICD), die Wiedererlangung der täglichen Aktivitäten, Partnerbeziehungen und den Umgang mit Gesundheitsanbietern [365]. Ein systematischer Review-Artikel über Patienten mit koronarer Herzerkrankung zeigt, wie wichtig eine proaktive Informationsversorgung und Ausbildung dieser Patienten ist [366].
Sowohl die kognitiven als auch die emotionalen Probleme haben einen erheblichen Einfluss und können das tägliche Leben des Patienten, die Wiedereingliederung in das Arbeitsleben und die Lebensqualität beeinträchtigen [356, 367, 368]. Aus diesem Grund scheint eine gezielte Nachsorge und Rehabilitation nach der Entlassung aus dem Krankenhaus notwendig zu sein. Obwohl die Beweise für die Sinnhaftigkeit einer Rehabilitationsbehandlung rar sind, haben 3 randomisierte kontrollierte Studien gezeigt, dass das Ergebnis nach Reanimation und Kreislaufstillstand durch sie verbessert werden kann [369–371]. Erstens konnte gezeigt werden, dass eine Intervention mit 11 Sitzungen der Krankenpflege die kardiovaskuläre Mortalität und depressive Symptome reduzieren half. In diesen Sitzungen wurden Entspannungsübungen, Selbstmanagement, Bewältigungsstrategien und Gesundheitserziehung trainiert und geschult [369]. Andere Pflegeinterventionen verbesserten die körperlichen Symptome, Angst, Selbstvertrauen und Wissen über die Krankheit [370, 371]. Diese Intervention bestand aus 8 Telefonsitzungen, ein 24/7-Krankenschwester-Rufsystem und eine Informationsbroschüre und zielte auf die Verbesserung der Selbstwirksamkeit, der Ergebniswirksamkeitserwartung und der Anhebung der Verhaltenskompetenzen im Selbstmanagement ab [372]. Eine dritte Intervention – bezeichnet als „Stand still …, and move on“ – verbesserte den emotionalen Gesamtzustand, die Angststörung und die Lebensqualität und erlaubte eine schnellere Wiedereingliederung in das Arbeitsleben [373]. Diese Intervention zielte darauf ab, frühzeitig kognitive und emotionale Probleme zu erkennen sowie Informationen und Unterstützung zur Verfügung zu stellen, um das Selbstmanagement zu fördern und auf eine spezialisierte Versorgung hinzuweisen, wenn diese erforderlich war [374, 375]. Dieses Programm bestand aus nur ein oder zwei Konsultationen einer spezialisierten Krankenschwester und den Erläuterungen in einer entsprechenden Informationsbroschüre.
Die Organisation der weiteren Versorgung nach Entlassung aus dem Krankenhaus, wenn ein Kreislaufstillstand überlebt wurde, variiert zwischen den Krankenhäusern und Ländern in Europa stark. Die Nachsorge muss aber systematisch organisiert werden und kann durch einen Arzt oder eine spezialisierte Krankenschwester erfolgen. Folgende Aspekte sollen dabei berücksichtigt werden:
-
Screening auf kognitive Beeinträchtigungen. Aktuell gibt es keinen Goldstandard, wie man ein solches Screening durchführen soll. Ein guter erster Schritt wäre es aber, den Patienten und seine Angehörigen und Betreuer nach kognitiven Beschwerden zu fragen (z. B. Probleme mit dem Gedächtnis, der Aufmerksamkeit oder im Planungsvermögen). Wenn machbar, sollen ein strukturiertes Interview oder Checklisten verwendet werden, wie z. B. die Checkliste „Cognition and Emotion“ [376] oder eine kurzes kognitives Screening-Instrument, wie das „Montreal Cognitive Assessment“ (MoCA), welches in vielen Sprachen frei erhältlich ist unter http://www.mocatest.org. Bei den Patienten, bei denen es Anzeichen für kognitive Beeinträchtigungen gibt, soll ein Spezialist zur neuropsychologischen Beurteilung und/oder für Rehabilitationsmedizin in die Behandlung mit eingebunden werden, um ein individuelles Rehabilitationsprogramm einzuleiten [377].
-
Screening auf emotionale Probleme. Fragen Sie, ob beim Patienten emotionale Probleme vorliegen, wie beispielsweise Symptome einer Depression, Angststörung oder eines posttraumatischen Belastungssyndroms. Allgemeine Untersuchungsmethoden sind z. B. die „Hospital Anxiety and Depression Scale“ (HADS) und die „Impact of Event Scale“ [378, 379]. Bei emotionalen Problemen soll ein Psychologe oder Psychiater in die Behandlung mit einbezogen werden [355].
-
Bereitstellung von Informationen. Informieren Sie den Patienten und seine Angehörigen proaktiv über die möglichen nicht kardialen Folgen eines Kreislaufstillstands – einschließlich der möglichen kognitiven Beeinträchtigungen, emotionalen Probleme und des Erschöpfungssyndroms. Weitere Themen, die besprochen und angegangen werden können, sind u. a. Herzerkrankungen, ICDs, Wiedererlangung der täglichen Aktivitäten, Partnerbeziehungen und Sexualität, Umgang mit Gesundheitsdienstleistern und Belastung für die Pflegenden [365].
Am besten ist es, schriftliche Informationen mit der Möglichkeit zur persönlichen Beratung zu kombinieren. Ein Beispiel einer Informationsbroschüre ist in den Sprachen Niederländisch und Englisch verfügbar [373, 374].
Organspende
Eine Organspende soll dann überlegt werden, wenn der Patient ROSC erreicht hatte und die Hirntodkriterien erfüllt sind oder ein irreversibler Hirnfunktionsausfall sicher festgestellt wurde [380]. In komatösen Patienten, bei denen die Entscheidung getroffen wird, lebenserhaltende Maßnahmen zu unterlassen, soll eine Organspende nach Eintritt des Kreislaufstillstands erwogen werden, wenn es rechtlich zulässig ist. Eine Organspende kann auch bei Personen erwogen werden, bei denen eine Reanimationsbehandlung nicht erfolgreich war und kein ROSC erreicht wurde. Alle Entscheidungen hierzu müssen den nationalen/lokalen rechtlichen und ethischen Anforderungen entsprechen, da diese von Land zu Land sehr verschieden sind.
(Cave: In Deutschland dürfen – dem deutschen Transplantationsgesetz, TPG, zufolge – Herztoten, „non heart-beating donor“, NHBD, nur dann Organe entnommen werden, wenn der Hirntod eindeutig festgestellt wurde oder seit dem Kreislaufstillstand mindestens 3 h vergangen sind.)
Nicht randomisierte Studien haben gezeigt, dass das Transplantatüberleben nach 1 Jahr ähnlich gut ist, wenn man Spender mit und ohne CPR vergleicht: Erwachsenenherzen (3230 Organe [381–387]), -lungen (1031 Organe [383, 385, 388]), -nieren (5000 Organe [381, 383]), -lebern (2911 Organe [381, 383]) und -darm (25 Organe [383]).
Nicht randomisierte Studien haben ebenfalls gezeigt, dass das Transplantatüberleben nach 1 Jahr ähnlich gut ist, wenn Organe von Spendern mit laufender CPR gewonnen wurden oder es sich um andere Arten von Spendern handelte: Nieren von Erwachsenen (199 Organe [389–391]) oder Lebern von Erwachsenen (60 Organe [390, 392, 393]).
Solide Organe wurden erfolgreich transplantiert, wenn sie nach dem Kreislaufstillstand des Spenders explantiert und später transplantiert wurden (NHBD). Diese Gruppe von Patienten bietet die Möglichkeit, den Pool an potenziellen Spenderorganen zu erhöhen. Die Organentnahme zur Spende nach dem Kreislauftod („donation after circulatory deth“, DCD) wird klassifiziert als geplante und ungeplante Entnahme [394, 395]. Die geplante Organentnahme betrifft hierbei Patienten, denen geplant eine lebenserhaltende Therapie bei nicht überlebensfähiger Verletzungen oder Krankheiten entzogen wird. Die unkontrollierte Spende beschreibt z. B. eine Organentnahme bei Patienten mit erfolgloser CPR, bei denen die Entscheidung zur Beendigung der Reanimationsmaßnahmen getroffen wurde. Nachdem der Tod festgestellt wurde, folgt ein vordefinierter Beobachtungszeitraum, indem geprüft wird, ob ein Spontankreislauf zurückkehrt oder nicht [396] (dieser beträgt in Deutschland mindestens 3 h). Anschließend kann ggf. eine Organkonservierung und Organentnahme erfolgen. Aspekte der ungeplanten Organspende sind komplex und umstritten, da die gleichen Techniken verwendet werden, entweder um den Menschen per CPR wiederzubeleben oder aber die möglichen Spenderorgane zu konservieren, nachdem der Tod des Patienten bestätigt worden ist. Hierzu gehören z. B. die mechanische Thoraxkompression und die extrakorporale Zirkulation. Insofern ist es zwingend erforderlich, die bestehenden nationalen Gesetze oder die lokal vereinbarten Protokolle strikt zu beachten.
Screening auf vererbbare Erkrankungen
Viele Opfer eines plötzlichen Herztods oder Kreislaufstillstands anderer Ursache haben unerkannte strukturelle Herzerkrankungen. Am häufigsten wird eine koronare Herzkrankheit diagnostiziert, aber auch primäre Herzrhythmusstörungen, eine Kardiomyopathie oder eine familiäre Hypercholesterinämie mit vorzeitiger ischämischer Herzerkrankung sind ursächlich verantwortlich. Insofern ist ein Screening auf vererbbare Erkrankungen oder Erkrankungen mit genetischer Dispositon von entscheidender Bedeutung für die Primärprävention im Verwandtenkreis der Patienten, wie es z. B. mit einer präventiven antiarrhythmischen Behandlung und medizinischen Vorsorgeuntersuchungen möglich ist [397–399]. Dieses Screening soll mittels einer gründlichen klinischen Anamnese und Untersuchung sowie der elektrophysiologischen und bildgebenden Untersuchung des Herzens durchgeführt werden. In ausgewählten Fällen sollen nach genetischen Mutationen, welche mit vererbten Herzerkrankungen assoziiert sind, gesucht werden [400].
Cardiac-Arrest-Zentren
Krankenhäuser, die Patienten nach Reanimation und Kreislaufstillstand behandeln, weisen eine hohe Variation ihrer intrahospitalen Mortalität für diese Patienten auf [9, 13, 16, 17, 401–403]. Viele Studien haben einen Zusammenhang zwischen der Krankenhausentlassungsrate und der Behandlung in einem Cardiac-Arrest-Zentrum berichtet, aber bedauerlicherweise sind die Krankenhausfaktoren, welche das Überleben der Patienten am meisten beeinflussen, nicht konsistent definiert [4, 5, 9, 17, 401, 404–416]. Darüber hinaus sind Art und Umfang der Dienste, die ein Cardiac-Arrest-Zentrum vorhalten soll, nicht einheitlich festgelegt. Die meisten Experten sind sich aber einig, dass ein solches Zentrum sowohl ein Herzkatheterlabor vorweisen muss, was sofort und jederzeit (24/7) zugänglich ist, als auch in der Lage zu sein hat, eine TTM-Behandlung jederzeit bereitzustellen. Wichtig ist auch die Verfügbarkeit eines neurologischen Dienstes, der die neuroelektrophysiologische Überwachung (Elektroenzephalographie, EEG) und Untersuchung (z. B. EEG und somatosensorisch evozierte Potenziale, SSEP) sicherstellen kann.
Es gibt einige Studien mit niedriger Evidenz, die möglicherweise zeigen, dass Intensivstationen mit mehr als 50 behandelten Patienten nach Reanimation pro Jahr bessere Überlebenschancen erreichen als Stationen mit weniger als 20 Fällen pro Jahr [17]. Diese Unterschiede können jedoch auch durch unterschiedliche Risiken im Patientgut bedingt sein. Eine Beobachtungsstudie zeigte – nicht risikoadjustiert –, dass die Entlassungsrate in größeren Krankenhäusern mit mehr als 40 Postreanimationspatienten pro Jahr im Vergleich zu denen, die jährlich weniger als 40 behandeln, besser war. Dieser rechnerische Unterschied verschwand jedoch, nachdem eine Risikoadjustierung für die Patientenfaktoren vorgenommen wurde [417].
Mehrere Studien mit historischen Kontrollgruppen haben gezeigt, dass die Implementierung eines umfassenden Pakets zur Postreanimationsbehandlung das Überleben nach ROSC verbessert. Dieses beinhaltet unter anderem die milde induzierte Hypothermie und die perkutane koronare Intervention [7, 10, 11, 417]. Es gibt auch Hinweise auf eine verbesserte Überlebensrate nach prähospitalem Kreislaufstillstand in großen Kliniken mit Herzkatheterlabor im Vergleich zu kleineren Krankenhäusern ohne Herzkatheterlabor [9]. In einer Studie des Resuscitation Outcome Consortium (ROC) mit 3981 Patienten, welche mit Spontankreislauf in eines von 151 Krankenhäusern aufgenommen wurden, konnten die Forscher zeigen, dass die frühe Koronarintervention und die milde induzierte Hypothermie mit einem günstigen Ergebnis assoziiert waren [84]. Diese Interventionen wurden häufiger in den Krankenhäusern durchgeführt, die mehr Patienten nach prähospitalem Kreislaufstillstand behandelten.
Mehrere Studien nach prähospitalem Kreislaufstillstand konnten keinen Zusammenhang zwischen der Transportzeit vom Einsatzort bis zur Aufnahme im Krankenhaus auf die Krankenhausentlassungsrate demonstrieren, wenn ROSC am Einsatzort erreicht wurde und die Tranportzeit kurz war (3–11 min) [406, 412, 413]. Dies impliziert, dass es sicher sein soll, nicht das nächste Krankenhaus anzufahren, sondern den Patienten post reanimationem schnellstmöglich in ein Cardiac-Arrest-Zentrum zu transportieren. Es gibt indirekte Hinweise dafür, dass regionale Reanimationsnetzwerke zu verbesserten Ergebnissen bei der Versorgung bei ST-Hebungsinfarkt (STEMI) führen [407, 418–441].
Die Schlussfolgerung aus all diesen Daten ist, dass die spezialisierten Cardiac-Arrest-Zentren und Reanimationsnetzwerke effektiv sein können [442–445]. Trotz des Mangels an qualitativ hochwertigen Daten, welche die Implementierung von Cardiac-Arrest-Zentren unterstützen, scheint es wahrscheinlich, dass die Spezialisierung und Regionalisierung der Postreanimationsbehandlung in den meisten Ländern übernommen wird.
Korrespondierende Übersetzer
Prof. Dr. med. Volker Dörges
Klinik für Anästhesiologie und Operative Intensivmedizin
Experimentelle Forschung und Labor
Arnold-Heller-Straße 3, Haus 12
24105 Kiel
Prof. Dr. med. Matthias Fischer
Klinik für Anästhesiologie, Operative Intensivmedizin,
Notfallmedizin und Schmerztherapie
Alb Fils Kliniken GmbH
Klinik am Eichert
Eichertstr. 3 / Postfach 660
73006 Göppingen
matthias.fischer@af-k.de
Literatur
Deakin CD, Nolan JP, Soar J et al (2010) European resuscitation council guidelines for resuscitation 2010 section 4. adult advanced life support. Resuscitation 81:1305–1352
Nolan J, Soar J, Eikeland H (2006) The chain of survival. Resuscitation 71:270–271
Nolan JP, Neumar RW, Adrie C et al (2008) Post-cardiac arrest syndrome: epidemiology, pathophysiology, treatment, and prognostication. A scientific statement from the international liaison committee on resuscitation; the American heart association emergency cardiovascular care committee; the council on cardiovascular surgery and anesthesia; the council on cardiopulmonary, perioperative, and critical care; the council on clinical cardiology; the council on stroke. Resuscitation 79:350–379
Spaite DW, Bobrow BJ, Stolz U et al (2014) Statewide regionalization of postarrest care for out-of-hospital cardiac arrest: association with survival and neurologic outcome. Ann Emerg Med 64:496–506e1
Soholm H, Wachtell K, Nielsen SL et al (2013) Tertiary centres have improved survival compared to other hospitals in the copenhagen area after out-of-hospital cardiac arrest. Resuscitation 84:162–167
Kirves H, Skrifvars MB, Vahakuopus M, Ekstrom K, Martikainen M, Castren M (2007) Adherence to resuscitation guidelines during prehospital care of cardiac arrest patients. Eur J Emerg Med 14:75–81
Sunde K, Pytte M, Jacobsen D et al (2007) Implementation of a standardised treatment protocol for post resuscitation care after out-of-hospital cardiac arrest. Resuscitation 73:29–39
Gaieski DF, Band RA, Abella BS et al (2009) Early goal-directed hemodynamic optimization combined with therapeutic hypothermia in comatose survivors of out-of-hospital cardiac arrest. Resuscitation 80:418–424
Carr BG, Goyal M, Band RA et al (2009) A national analysis of the relationship between hospital factors and post-cardiac arrest mortality. Intensive Care Med 35:505–511
Oddo M, Schaller MD, Feihl F, Ribordy V, Liaudet L (2006) From evidence to clinical practice: effective implementation of therapeutic hypothermia to improve patient outcome after cardiac arrest. Crit Care Med 34:1865–1873
Knafelj R, Radsel P, Ploj T, Noc M (2007) Primary percutaneous coronary intervention and mild induced hypothermia in comatose survivors of ventricular fibrillation with ST-elevation acute myocardial infarction. Resuscitation 74:227–234
Deakin CD, Fothergill R, Moore F, Watson L, Whitbread M (2014) Level of consciousness on admission to a heart attack centre is a predictor of survival from out-of-hospital cardiac arrest. Resuscitation 85:905–909
Langhelle A, Tyvold SS, Lexow K, Hapnes SA, Sunde K, Steen PA (2003) In-hospital factors associated with improved outcome after out-of-hospital cardiac arrest. A comparison between four regions in Norway. Resuscitation 56:247–263
Tomte O, Andersen GO, Jacobsen D, Draegni T, Auestad B, Sunde K (2011) Strong and weak aspects of an established post-resuscitation treatment protocol-A five-year observational study. Resuscitation 82:1186–1193
Nolan JP, Laver SR, Welch CA, Harrison DA, Gupta V, Rowan K (2007) Outcome following admission to UK intensive care units after cardiac arrest: a secondary analysis of the ICNARC Case Mix Programme Database. Anaesthesia 62:1207–1216
Keenan SP, Dodek P, Martin C, Priestap F, Norena M, Wong H (2007) Variation in length of intensive care unit stay after cardiac arrest: where you are is as important as who you are. Crit Care Med 35:836–841
Carr BG, Kahn JM, Merchant RM, Kramer AA, Neumar RW (2009) Inter-hospital variability in post-cardiac arrest mortality. Resuscitation 80:30–34
Niskanen M, Reinikainen M, Kurola J (2007) Outcome from intensive care after cardiac arrest: comparison between two patient samples treated in 1986–87 and 1999–2001 in Finnish ICUs. Acta Anaesthesiol Scand 51:151–157
Hovdenes J, Laake JH, Aaberge L, Haugaa H, Bugge JF (2007) Therapeutic hypothermia after out-of-hospital cardiac arrest: experiences with patients treated with percutaneous coronary intervention and cardiogenic shock. Acta Anaesthesiol Scand 51:137–142
Nielsen N, Hovdenes J, Nilsson F et al (2009) Outcome, timing and adverse events in therapeutic hypothermia after out-of-hospital cardiac arrest. Acta Anaesthesiol Scand 53:926–934
Sulzgruber P, Kliegel A, Wandaller C et al (2015) Survivors of cardiac arrest with good neurological outcome show considerable impairments of memory functioning. Resuscitation 88:120–125
Lilja G, Nielsen N, Friberg H et al (2015) Cognitive function in survivors of out-of-hospital cardiac arrest after target temperature management at 33 degrees C versus 36 degrees C. Circulation 131:1340–1349
Moulaert VRMP, Verbunt JA, van Heugten CM, Wade DT (2009) Cognitive impairments in survivors of out-of-hospital cardiac arrest: a systematic review. Resuscitation 80:297–305
Cronberg T, Lilja G, Horn J et al (2015) Neurologic function and health-related quality of life in patients following targeted temperature management at 33 degrees c vs 36 degrees c after out-of-hospital cardiac arrest: a randomized clinical trial. JAMA Neurol 72(6):634–641
Mongardon N, Dumas F, Ricome S et al (2011) Postcardiac arrest syndrome: from immediate resuscitation to long-term outcome. Ann Intensive Care 1:45
Stub D, Bernard S, Duffy SJ, Kaye DM (2011) Post cardiac arrest syndrome: a review of therapeutic strategies. Circulation 123:1428–1435
Lemiale V, Dumas F, Mongardon N et al (2013) Intensive care unit mortality after cardiac arrest: the relative contribution of shock and brain injury in a large cohort. Intensive Care Med 39:1972–1980
Laver S, Farrow C, Turner D, Nolan J (2004) Mode of death after admission to an intensive care unit following cardiac arrest. Intensive Care Med 30:2126–2128
Olasveengen TM, Sunde K, Brunborg C, Thowsen J, Steen PA, Wik L (2009) Intravenous drug administration during out-of-hospital cardiac arrest: a randomized trial. JAMA 302:2222–2229
Dragancea I, Rundgren M, Englund E, Friberg H, Cronberg T (2013) The influence of induced hypothermia and delayed prognostication on the mode of death after cardiac arrest. Resuscitation 84:337–342
Nielsen N, Wetterslev J, Cronberg T et al (2013) Targeted temperature management at 33 degrees C versus 36 degrees C after cardiac arrest. N Engl J Med 369:2197–2206
Laurent I, Monchi M, Chiche JD et al (2002) Reversible myocardial dysfunction in survivors of out-of-hospital cardiac arrest. J Am Coll Cardiol 40:2110–2116
Ruiz-Bailen M, Aguayo de Hoyos E, Ruiz-Navarro S et al (2005) Reversible myocardial dysfunction after cardiopulmonary resuscitation. Resuscitation 66:175–181
Chalkias A, Xanthos T (2012) Pathophysiology and pathogenesis of post-resuscitation myocardial stunning. Heart Fail Rev 17:117–128
Cerchiari EL, Safar P, Klein E, Diven W (1993) Visceral, hematologic and bacteriologic changes and neurologic outcome after cardiac arrest in dogs. The visceral post-resuscitation syndrome. Resuscitation 25:119–136
Adrie C, Monchi M, Laurent I et al (2005) Coagulopathy after successful cardiopulmonary resuscitation following cardiac arrest: implication of the protein C anticoagulant pathway. J Am Coll Cardiol 46:21–28
Grimaldi D, Guivarch E, Neveux N et al (2013) Markers of intestinal injury are associated with endotoxemia in successfully resuscitated patients. Resuscitation 84:60–65
Roberts BW, Kilgannon JH, Chansky ME et al (2013) Multiple organ dysfunction after return of spontaneous circulation in postcardiac arrest syndrome. Crit Care Med 41:1492–1501
Bottiger BW, Bohrer H, Boker T, Motsch J, Aulmann M, Martin E (1996) Platelet factor 4 release in patients undergoing cardiopulmonary resuscitation–can reperfusion be impaired by platelet activation? Acta Anaesthesiol Scand 40:631–635
Bottiger BW, Motsch J, Braun V, Martin E, Kirschfink M (2002) Marked activation of complement and leukocytes and an increase in the concentrations of soluble endothelial adhesion molecules during cardiopulmonary resuscitation and early reperfusion after cardiac arrest in humans. Crit Care Med 30:2473–2480
Bottiger BW, Motsch J, Bohrer H et al (1995) Activation of blood coagulation after cardiac arrest is not balanced adequately by activation of endogenous fibrinolysis. Circulation 92:2572–2578
Adrie C, Adib-Conquy M, Laurent I et al (2002) Successful cardiopulmonary resuscitation after cardiac arrest as a „sepsis-like“ syndrome. Circulation 106:562–568
Adrie C, Laurent I, Monchi M, Cariou A, Dhainaou JF, Spaulding C (2004) Postresuscitation disease after cardiac arrest: a sepsis-like syndrome? Curr Opin Crit Care 10:208–212
Huet O, Dupic L, Batteux F et al (2011) Postresuscitation syndrome: potential role of hydroxyl radical-induced endothelial cell damage. Crit Care Med 39:1712–1720
Fink K, Schwarz M, Feldbrugge L et al (2010) Severe endothelial injury and subsequent repair in patients after successful cardiopulmonary resuscitation. Crit Care 14:R104
van Genderen ME, Lima A, Akkerhuis M, Bakker J, van Bommel J (2012) Persistent peripheral and microcirculatory perfusion alterations after out-of-hospital cardiac arrest are associated with poor survival. Crit Care Med 40:2287–2294
Bro-Jeppesen J, Kjaergaard J, Wanscher M et al (2015) Systemic inflammatory response and potential prognostic implications after out-of-hospital cardiac arrest: a substudy of the target temperature management trial. Crit Care Med 43:1223–1232
Sutherasan Y, Penuelas O, Muriel A et al (2015) Management and outcome of mechanically ventilated patients after cardiac arrest. Crit Care 19:215
Pilcher J, Weatherall M, Shirtcliffe P, Bellomo R, Young P, Beasley R (2012) The effect of hyperoxia following cardiac arrest – a systematic review and meta-analysis of animal trials. Resuscitation 83:417–422
Zwemer CF, Whitesall SE, DʼAlecy LG (1994) Cardiopulmonary-cerebral resuscitation with 100 % oxygen exacerbates neurological dysfunction following nine minutes of normothermic cardiac arrest in dogs. Resuscitation 27:159–170
Richards EM, Fiskum G, Rosenthal RE, Hopkins I, McKenna MC (2007) Hyperoxic reperfusion after global ischemia decreases hippocampal energy metabolism. Stroke 38:1578–1584
Vereczki V, Martin E, Rosenthal RE, Hof PR, Hoffman GE, Fiskum G (2006) Normoxic resuscitation after cardiac arrest protects against hippocampal oxidative stress, metabolic dysfunction, and neuronal death. J Cereb Blood Flow Metab 26:821–835
Liu Y, Rosenthal RE, Haywood Y, Miljkovic-Lolic M, Vanderhoek JY, Fiskum G (1998) Normoxic ventilation after cardiac arrest reduces oxidation of brain lipids and improves neurological outcome. Stroke 29:1679–1686
Balan IS, Fiskum G, Hazelton J, Cotto-Cumba C, Rosenthal RE (2006) Oximetry-guided reoxygenation improves neurological outcome after experimental cardiac arrest. Stroke 37:3008–3013
Kilgannon JH, Jones AE, Shapiro NI et al (2010) Association between arterial hyperoxia following resuscitation from cardiac arrest and in-hospital mortality. JAMA 303:2165–2171
Kilgannon JH, Jones AE, Parrillo JE et al (2011) Relationship between supranormal oxygen tension and outcome after resuscitation from cardiac arrest. Circulation 123:2717–2722
Janz DR, Hollenbeck RD, Pollock JS, McPherson JA, Rice TW (2012) Hyperoxia is associated with increased mortality in patients treated with mild therapeutic hypothermia after sudden cardiac arrest. Crit Care Med 40:3135–3139
Bellomo R, Bailey M, Eastwood GM et al (2011) Arterial hyperoxia and in-hospital mortality after resuscitation from cardiac arrest. Crit Care 15:R90
Wang CH, Chang WT, Huang CH et al (2014) The effect of hyperoxia on survival following adult cardiac arrest: a systematic review and meta-analysis of observational studies. Resuscitation 85:1142–1148
Young P, Bailey M, Bellomo R et al (2014) HyperOxic Therapy OR NormOxic Therapy after out-of-hospital cardiac arrest (HOT OR NOT): a randomised controlled feasibility trial. Resuscitation 85:1686–1691
Stub D, Smith K, Bernard S et al (2015) Air versus oxygen in ST-segment elevation myocardial infarction. Circulation 131(24):2143–2150
Menon DK, Coles JP, Gupta AK et al (2004) Diffusion limited oxygen delivery following head injury. Crit Care Med 32:1384–1390
Bouzat P, Suys T, Sala N, Oddo M (2013) Effect of moderate hyperventilation and induced hypertension on cerebral tissue oxygenation after cardiac arrest and therapeutic hypothermia. Resuscitation 84:1540–1545
Buunk G, van der Hoeven JG, Meinders AE (1997) Cerebrovascular reactivity in comatose patients resuscitated from a cardiac arrest. Stroke 28:1569–1573
Buunk G, van der Hoeven JG, Meinders AE (1998) A comparison of near-infrared spectroscopy and jugular bulb oximetry in comatose patients resuscitated from a cardiac arrest. Anaesthesia 53:13–19
Roine RO, Launes J, Nikkinen P, Lindroth L, Kaste M (1991) Regional cerebral blood flow after human cardiac arrest. A hexamethylpropyleneamine oxime single photon emission computed tomographic study. Arch Neurol 48:625–629
Beckstead JE, Tweed WA, Lee J, MacKeen WL (1978) Cerebral blood flow and metabolism in man following cardiac arrest. Stroke 9:569–573
Roberts BW, Kilgannon JH, Chansky ME, Mittal N, Wooden J, Trzeciak S (2013) Association between postresuscitation partial pressure of arterial carbon dioxide and neurological outcome in patients with post-cardiac arrest syndrome. Circulation 127:2107–2113
Schneider AG, Eastwood GM, Bellomo R et al (2013) Arterial carbon dioxide tension and outcome in patients admitted to the intensive care unit after cardiac arrest. Resuscitation 84:927–934
Vaahersalo J, Bendel S, Reinikainen M et al (2014) Arterial blood gas tensions after resuscitation from out-of-hospital cardiac arrest: associations with long-term neurologic outcome. Crit Care Med 42:1463–1470
Falkenbach P, Kamarainen A, Makela A et al (2009) Incidence of iatrogenic dyscarbia during mild therapeutic hypothermia after successful resuscitation from out-of-hospital cardiac arrest. Resuscitation 80:990–993
Slutsky AS, Ranieri VM (2013) Ventilator-induced lung injury. N Engl J Med 369:2126–2136
Alhazzani W, Alshahrani M, Jaeschke R et al (2013) Neuromuscular blocking agents in acute respiratory distress syndrome: a systematic review and meta-analysis of randomized controlled trials. Crit Care 17:R43
Salciccioli JD, Cocchi MN, Rittenberger JC et al (2013) Continuous neuromuscular blockade is associated with decreased mortality in post-cardiac arrest patients. Resuscitation 84:1728–1733
Rundgren M, Westhall E, Cronberg T, Rosen I, Friberg H (2010) Continuous amplitude-integrated electroencephalogram predicts outcome in hypothermia-treated cardiac arrest patients. Crit Care Med 38:1838–1844
Miller AC, Rosati SF, Suffredini AF, Schrump DS (2014) A systematic review and pooled analysis of CPR-associated cardiovascular and thoracic injuries. Resuscitation 85:724–731
Kashiwagi Y, Sasakawa T, Tampo A et al (2015) Computed tomography findings of complications resulting from cardiopulmonary resuscitation. Resuscitation 88:86–91
Larsen JM, Ravkilde J (2012) Acute coronary angiography in patients resuscitated from out-of-hospital cardiac arrest–a systematic review and meta-analysis. Resuscitation 83:1427–1433
Spaulding CM, Joly LM, Rosenberg A et al (1997) Immediate coronary angiography in survivors of out-of-hospital cardiac arrest. N Engl J Med 336:1629–1633
Camuglia AC, Randhawa VK, Lavi S, Walters DL (2014) Cardiac catheterization is associated with superior outcomes for survivors of out of hospital cardiac arrest: review and meta-analysis. Resuscitation 85:1533–1540
Grasner JT, Meybohm P, Caliebe A et al (2011) Postresuscitation care with mild therapeutic hypothermia and coronary intervention after out-of-hospital cardiopulmonary resuscitation: a prospective registry analysis. Crit Care 15:R61
Garcia-Tejada J, Jurado-Roman A, Rodriguez J et al (2014) Post-resuscitation electrocardiograms, acute coronary findings and in-hospital prognosis of survivors of out-of-hospital cardiac arrest. Resuscitation 85:1245–1250
Nikolaou NI, Arntz HR, Bellou A, Beygui F, Bossaert LL, Cariou A (2015) European resuscitation council guidelines for resuscitation 2015 Section 5. Initial management of acute coronary syndromes resuscitation
Callaway CW, Schmicker RH, Brown SP et al (2014) Early coronary angiography and induced hypothermia are associated with survival and functional recovery after out-of-hospital cardiac arrest. Resuscitation 85:657–663
Dumas F, White L, Stubbs BA, Cariou A, Rea TD (2012) Long-term prognosis following resuscitation from out of hospital cardiac arrest: role of percutaneous coronary intervention and therapeutic hypothermia. J Am Coll Cardiol 60:21–27
Zanuttini D, Armellini I, Nucifora G et al (2013) Predictive value of electrocardiogram in diagnosing acute coronary artery lesions among patients with out-of-hospital-cardiac-arrest. Resuscitation 84:1250–1254
Dumas F, Manzo-Silberman S, Fichet J et al (2012) Can early cardiac troponin I measurement help to predict recent coronary occlusion in out-of-hospital cardiac arrest survivors? Crit Care Med 40:1777–1784
Sideris G, Voicu S, Dillinger JG et al (2011) Value of post-resuscitation electrocardiogram in the diagnosis of acute myocardial infarction in out-of-hospital cardiac arrest patients. Resuscitation 82:1148–1153
Muller D, Schnitzer L, Brandt J, Arntz HR (2008) The accuracy of an out-of-hospital 12-lead ECG for the detection of ST-elevation myocardial infarction immediately after resuscitation. Ann Emerg Med 52:658–664
Dumas F, Cariou A, Manzo-Silberman S et al (2010) Immediate percutaneous coronary intervention is associated with better survival after out-of-hospital cardiac arrest: insights from the PROCAT (Parisian Region Out of hospital Cardiac ArresT) registry. Circ Cardiovasc Interv 3:200–207
Radsel P, Knafelj R, Kocjancic S, Noc M (2011) Angiographic characteristics of coronary disease and postresuscitation electrocardiograms in patients with aborted cardiac arrest outside a hospital. Am J Cardiol 108:634–638
Hollenbeck RD, McPherson JA, Mooney MR et al (2014) Early cardiac catheterization is associated with improved survival in comatose survivors of cardiac arrest without STEMI. Resuscitation 85:88–95
Redfors B, Ramunddal T, Angeras O et al (2015) Angiographic findings and survival in patients undergoing coronary angiography due to sudden cardiac arrest in Western Sweden. Resuscitation 90:13–20
Bro-Jeppesen J, Kjaergaard J, Wanscher M et al (2012) Emergency coronary angiography in comatose cardiac arrest patients: do real-life experiences support the guidelines? Eur Heart J Acute Cardiovasc Care 1:291–301
Dankiewicz J, Nielsen N, Annborn M et al (2015) Survival in patients without acute ST elevation after cardiac arrest and association with early coronary angiography: a post hoc analysis from the TTM trial. Intensive Care Med 41:856–864
Noc M, Fajadet J, Lassen JF et al (2014) Invasive coronary treatment strategies for out-of-hospital cardiac arrest: a consensus statement from the European association for percutaneous cardiovascular interventions (EAPCI)/stent for life (SFL) groups. EuroIntervention 10:31–37
Chelly J, Mongardon N, Dumas F et al (2012) Benefit of an early and systematic imaging procedure after cardiac arrest: insights from the PROCAT (Parisian Region Out of Hospital Cardiac Arrest) registry. Resuscitation 83:1444–1450
Arnaout M, Mongardon N, Deye N et al (2015) Out-of-hospital cardiac arrest from brain cause: epidemiology, clinical features, and outcome in a multicenter cohort*. Crit Care Med 43:453–460
Caputo ND, Stahmer C, Lim G, Shah K (2014) Whole-body computed tomographic scanning leads to better survival as opposed to selective scanning in trauma patients: a systematic review and meta-analysis. J Trauma Acute Care Surg 77:534–539
Truhlar A, Deakin CD, Soar J et al (2015) European resuscitation council guidelines for resuscitation 2015 section 4 cardiac arrest in special circumstances. Resuscitation
Bro-Jeppesen J, Annborn M, Hassager C et al (2015) Hemodynamics and vasopressor support during targeted temperature management at 33 degrees C Versus 36 degrees C after out-of-hospital cardiac arrest: a post hoc study of the target temperature management trial*. Crit Care Med 43:318–327
Chang WT, Ma MH, Chien KL et al (2007) Postresuscitation myocardial dysfunction: correlated factors and prognostic implications. Intensive Care Med 33:88–95
Kern KB, Hilwig RW, Berg RA et al (1997) Postresuscitation left ventricular systolic and diastolic dysfunction: treatment with dobutamine. Circulation 95:2610–2613
Vasquez A, Kern KB, Hilwig RW, Heidenreich J, Berg RA, Ewy GA (2004) Optimal dosing of dobutamine for treating post-resuscitation left ventricular dysfunction. Resuscitation 61:199–207
Manzo-Silberman S, Fichet J, Mathonnet A et al (2013) Percutaneous left ventricular assistance in post cardiac arrest shock: comparison of intra aortic blood pump and IMPELLA Recover LP2.5. Resuscitation 84:609–615
Thiele H, Zeymer U, Neumann FJ et al (2012) Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med 367:1287–1296
Ahmad Y, Sen S, Shun-Shin MJ et al (2015) Intra-aortic balloon pump therapy for acute myocardial infarction: a meta-analysis. JAMA Intern Med 175(6):931–939
Dellinger RP, Levy MM, Rhodes A et al (2013) Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med 41:580–637
Pro CI, Yealy DM, Kellum JA et al (2014) A randomized trial of protocol-based care for early septic shock. N Engl J Med 370:1683–1693
Investigators A, Group ACT, Peake SL et al (2014) Goal-directed resuscitation for patients with early septic shock. N Engl J Med 371:1496–1506
Mouncey PR, Osborn TM, Power GS et al (2015) Trial of early, goal-directed resuscitation for septic shock. N Engl J Med 372:1301–1311
Beylin ME, Perman SM, Abella BS et al (2013) Higher mean arterial pressure with or without vasoactive agents is associated with increased survival and better neurological outcomes in comatose survivors of cardiac arrest. Intensive Care Med 39:1981–1988
Kilgannon JH, Roberts BW, Jones AE et al (2014) Arterial blood pressure and neurologic outcome after resuscitation from cardiac arrest*. Crit Care Med 42:2083–2091
Walters EL, Morawski K, Dorotta I et al (2011) Implementation of a post-cardiac arrest care bundle including therapeutic hypothermia and hemodynamic optimization in comatose patients with return of spontaneous circulation after out-of-hospital cardiac arrest: a feasibility study. Shock 35:360–366
Zeiner A, Sunder-Plassmann G, Sterz F et al (2004) The effect of mild therapeutic hypothermia on renal function after cardiopulmonary resuscitation in men. Resuscitation 60:253–261
Torgersen C, Meichtry J, Schmittinger CA et al (2013) Haemodynamic variables and functional outcome in hypothermic patients following out-of-hospital cardiac arrest. Resuscitation 84:798–804
Post H, Schmitto JD, Steendijk P et al (2010) Cardiac function during mild hypothermia in pigs: increased inotropy at the expense of diastolic dysfunction. Acta Physiol (Oxf) 199:43–52
Staer-Jensen H, Sunde K, Olasveengen TM et al (2014) Bradycardia during therapeutic hypothermia is associated with good neurologic outcome in comatose survivors of out-of-hospital cardiac arrest. Crit Care Med 42:2401–2408
Thomsen JH, Hassager C, Bro-Jeppesen J et al (2015) Sinus bradycardia during hypothermia in comatose survivors of out-of-hospital cardiac arrest – a new early marker of favorable outcome? Resuscitation 89:36–42
Pene F, Hyvernat H, Mallet V et al (2005) Prognostic value of relative adrenal insufficiency after out-of-hospital cardiac arrest. Intensive Care Med 31:627–633
Hekimian G, Baugnon T, Thuong M et al (2004) Cortisol levels and adrenal reserve after successful cardiac arrest resuscitation. Shock 22:116–119
Mentzelopoulos SD, Malachias S, Chamos C et al (2013) Vasopressin, steroids, and epinephrine and neurologically favorable survival after in-hospital cardiac arrest: a randomized clinical trial. JAMA 310:270–279
Mentzelopoulos SD, Zakynthinos SG, Tzoufi M et al (2009) Vasopressin, epinephrine, and corticosteroids for in-hospital cardiac arrest. Arch Intern Med 169:15–24
Lee DS, Green LD, Liu PP et al (2003) Effectiveness of implantable defibrillators for preventing arrhythmic events and death: a meta-analysis. J Am Coll Cardiol 41:1573–1582
Vardas PE, Auricchio A, Blanc JJ et al (2007) Guidelines for cardiac pacing and cardiac resynchronization therapy: the task force for cardiac pacing and cardiac resynchronization therapy of the European society of cardiology. Developed in collaboration with the European Heart Rhythm Association. Eur Heart J 28:2256–2295
Task Force on the management of STseamiotESoC, Steg PG, James SK et al (2012) ESC guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 33:2569–2619
John RM, Tedrow UB, Koplan BA et al (2012) Ventricular arrhythmias and sudden cardiac death. Lancet 380:1520–1529
Soar J, Callaway CW, Aibiki M et al (2015) Part 4: advanced life support: 2015 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations. Resuscitation
Buunk G, van der Hoeven JG, Meinders AE (2000) Cerebral blood flow after cardiac arrest. Neth J Med 57:106–112
Angelos MG, Ward KR, Hobson J, Beckley PD (1994) Organ blood flow following cardiac arrest in a swine low-flow cardiopulmonary bypass model. Resuscitation 27:245–254
Fischer M, Bottiger BW, Popov-Cenic S, Hossmann KA (1996) Thrombolysis using plasminogen activator and heparin reduces cerebral no-reflow after resuscitation from cardiac arrest: an experimental study in the cat. Intensive Care Med 22:1214–1223
Sakabe T, Tateishi A, Miyauchi Y et al (1987) Intracranial pressure following cardiopulmonary resuscitation. Intensive Care Med 13:256–259
Morimoto Y, Kemmotsu O, Kitami K, Matsubara I, Tedo I (1993) Acute brain swelling after out-of-hospital cardiac arrest: pathogenesis and outcome. Crit Care Med 21:104–110
Nishizawa H, Kudoh I (1996) Cerebral autoregulation is impaired in patients resuscitated after cardiac arrest. Acta Anaesthesiol Scand 40:1149–1153
Sundgreen C, Larsen FS, Herzog TM, Knudsen GM, Boesgaard S, Aldershvile J (2001) Autoregulation of cerebral blood flow in patients resuscitated from cardiac arrest. Stroke 32:128–132
Ameloot K, Genbrugge C, Meex I et al (2015) An observational near-infrared spectroscopy study on cerebral autoregulation in post-cardiac arrest patients: time to drop ‚one-size-fits-all‘ hemodynamic targets? Resuscitation 90:121–126
Chamorro C, Borrallo JM, Romera MA, Silva JA, Balandin B (2010) Anesthesia and analgesia protocol during therapeutic hypothermia after cardiac arrest: a systematic review. Anesth Analg 110:1328–1335
Bjelland TW, Dale O, Kaisen K et al (2012) Propofol and remifentanil versus midazolam and fentanyl for sedation during therapeutic hypothermia after cardiac arrest: a randomised trial. Intensive Care Med 38:959–967
Hellstrom J, Owall A, Martling CR, Sackey PV (2014) Inhaled isoflurane sedation during therapeutic hypothermia after cardiac arrest: a case series. Crit Care Med 42:e161–e166
Knapp J, Bergmann G, Bruckner T, Russ N, Bottiger BW, Popp E (2013) Pre- and postconditioning effect of Sevoflurane on myocardial dysfunction after cardiopulmonary resuscitation in rats. Resuscitation 84:1450–1455
Ely EW, Truman B, Shintani A et al (2003) Monitoring sedation status over time in ICU patients: reliability and validity of the Richmond Agitation-Sedation Scale (RASS). JAMA 289:2983–2991
De Jonghe B, Cook D, Appere-De-Vecchi C, Guyatt G, Meade M, Outin H (2000) Using and understanding sedation scoring systems: a systematic review. Intensive Care Med 26:275–285
Snyder BD, Hauser WA, Loewenson RB, Leppik IE, Ramirez-Lassepas M, Gumnit RJ (1980) Neurologic prognosis after cardiopulmonary arrest, III: seizure activity. Neurology 30:1292–1297
Bouwes A, van Poppelen D, Koelman JH et al (2012) Acute posthypoxic myoclonus after cardiopulmonary resuscitation. BMC Neurol 12:63
Seder DB, Sunde K, Rubertsson S et al (2015) Neurologic outcomes and postresuscitation care of patients with myoclonus following cardiac arrest. Crit Care Med 43:965–972
Benbadis SR, Chen S, Melo M (2010) Whatʼs shaking in the ICU? The differential diagnosis of seizures in the intensive care setting. Epilepsia 51:2338–2340
Caviness JN, Brown P (2004) Myoclonus: current concepts and recent advances. Lancet Neurol 3:598–607
Hirsch LJ, LaRoche SM, Gaspard N et al (2013) American clinical neurophysiology societyʼs standardized critical care EEG terminology: 2012 version. J Clin Neurophysiol 30:1–27
Mani R, Schmitt SE, Mazer M, Putt ME, Gaieski DF (2012) The frequency and timing of epileptiform activity on continuous electroencephalogram in comatose post-cardiac arrest syndrome patients treated with therapeutic hypothermia. Resuscitation 83:840–847
Legriel S, Hilly-Ginoux J, Resche-Rigon M et al (2013) Prognostic value of electrographic postanoxic status epilepticus in comatose cardiac-arrest survivors in the therapeutic hypothermia era. Resuscitation 84:343–350
Ingvar M (1986) Cerebral blood flow and metabolic rate during seizures. Relationship to epileptic brain damage. Ann N Y Acad Sci 462:194–206
Thomke F, Weilemann SL (2010) Poor prognosis despite successful treatment of postanoxic generalized myoclonus. Neurology 74:1392–1394
Randomized clinical study of thiopental loading in comatose survivors of cardiac arrest (1986) Brain resuscitation clinical trial i study group. N Engl J Med 314:397–403
Longstreth WT Jr, Fahrenbruch CE, Olsufka M, Walsh TR, Copass MK, Cobb LA (2002) Randomized clinical trial of magnesium, diazepam, or both after out-of-hospital cardiac arrest. Neurology 59:506–514
Amorim E, Rittenberger JC, Baldwin ME, Callaway CW, Popescu A, Post Cardiac Arrest S (2015) Malignant EEG patterns in cardiac arrest patients treated with targeted temperature management who survive to hospital discharge. Resuscitation 90:127–132
Samaniego EA, Mlynash M, Caulfield AF, Eyngorn I, Wijman CA (2011) Sedation confounds outcome prediction in cardiac arrest survivors treated with hypothermia. Neurocrit Care 15:113–119
Daviaud F, Dumas F, Demars N et al (2014) Blood glucose level and outcome after cardiac arrest: insights from a large registry in the hypothermia era. Intensive Care Med 40:855–862
Losert H, Sterz F, Roine RO et al (2007) Strict normoglycaemic blood glucose levels in the therapeutic management of patients within 12 h after cardiac arrest might not be necessary. Resuscitation 76(2):214–220
Skrifvars MB, Saarinen K, Ikola K, Kuisma M (2005) Improved survival after in-hospital cardiac arrest outside critical care areas. Acta Anaesthesiol Scand 49:1534–1539
Mullner M, Sterz F, Binder M, Schreiber W, Deimel A, Laggner AN (1997) Blood glucose concentration after cardiopulmonary resuscitation influences functional neurological recovery in human cardiac arrest survivors. J Cereb Blood Flow Metab 17:430–436
Calle PA, Buylaert WA, Vanhaute OA (1989) Glycemia in the post-resuscitation period. The cerebral resuscitation study group. Resuscitation 17(Suppl):S181–S188. (discussion S99–S206)
Longstreth WT Jr, Diehr P, Inui TS (1983) Prediction of awakening after out-of-hospital cardiac arrest. N Engl J Med 308:1378–1382
Longstreth WT Jr, Inui TS (1984) High blood glucose level on hospital admission and poor neurological recovery after cardiac arrest. Ann Neurol 15:59–63
van den Berghe G, Wouters P, Weekers F et al (2001) Intensive insulin therapy in the critically ill patients. N Engl J Med 345:1359–1367
Van den Berghe G, Wilmer A, Hermans G et al (2006) Intensive insulin therapy in the medical ICU. N Engl J Med 354:449–461
Oksanen T, Skrifvars MB, Varpula T et al (2007) Strict versus moderate glucose control after resuscitation from ventricular fibrillation. Intensive Care Med 33:2093–2100
Finfer S, Chittock DR, Su SY et al (2009) Intensive versus conventional glucose control in critically ill patients. N Engl J Med 360:1283–1297
Investigators N-SS, Finfer S, Liu B et al (2012) Hypoglycemia and risk of death in critically ill patients. N Engl J Med 367:1108–1118
Krinsley JS, Grover A (2007) Severe hypoglycemia in critically ill patients: risk factors and outcomes. Crit Care Med 35:2262–2267
Meyfroidt G, Keenan DM, Wang X, Wouters PJ, Veldhuis JD, Van den Berghe G (2010) Dynamic characteristics of blood glucose time series during the course of critical illness: effects of intensive insulin therapy and relative association with mortality. Crit Care Med 38:1021–1029
Cueni-Villoz N, Devigili A, Delodder F et al (2011) Increased blood glucose variability during therapeutic hypothermia and outcome after cardiac arrest. Crit Care Med 39:2225–2231
Padkin A (2009) Glucose control after cardiac arrest. Resuscitation 80:611–612
Takino M, Okada Y (1991) Hyperthermia following cardiopulmonary resuscitation. Intensive Care Med 17:419–420
Hickey RW, Kochanek PM, Ferimer H, Alexander HL, Garman RH, Graham SH (2003) Induced hyperthermia exacerbates neurologic neuronal histologic damage after asphyxial cardiac arrest in rats. Crit Care Med 31:531–535
Takasu A, Saitoh D, Kaneko N, Sakamoto T, Okada Y (2001) Hyperthermia: is it an ominous sign after cardiac arrest? Resuscitation 49:273–277
Zeiner A, Holzer M, Sterz F et al (2001) Hyperthermia after cardiac arrest is associated with an unfavorable neurologic outcome. Arch Intern Med 161:2007–2012
Hickey RW, Kochanek PM, Ferimer H, Graham SH, Safar P (2000) Hypothermia and hyperthermia in children after resuscitation from cardiac arrest. Pediatrics 106(pt 1):118–122
Diringer MN, Reaven NL, Funk SE, Uman GC (2004) Elevated body temperature independently contributes to increased length of stay in neurologic intensive care unit patients. Crit Care Med 32:1489–1495
Winters SA, Wolf KH, Kettinger SA, Seif EK, Jones JS, Bacon-Baguley T (2013) Assessment of risk factors for post-rewarming „rebound hyperthermia“ in cardiac arrest patients undergoing therapeutic hypothermia. Resuscitation 84:1245–1249
Bro-Jeppesen J, Hassager C, Wanscher M et al (2013) Post-hypothermia fever is associated with increased mortality after out-of-hospital cardiac arrest. Resuscitation 84:1734–1740
Leary M, Grossestreuer AV, Iannacone S et al (2013) Pyrexia and neurologic outcomes after therapeutic hypothermia for cardiac arrest. Resuscitation 84:1056–1061
Bro-Jeppesen J, Kjaergaard J, Horsted TI et al (2009) The impact of therapeutic hypothermia on neurological function and quality of life after cardiac arrest. Resuscitation 80:171–176
Gunn AJ, Thoresen M (2006) Hypothermic neuroprotection. NeuroRx 3:154–169
Froehler MT, Geocadin RG (2007) Hypothermia for neuroprotection after cardiac arrest: mechanisms, clinical trials and patient care. J Neurol Sci 261:118–126
McCullough JN, Zhang N, Reich DL et al (1999) Cerebral metabolic suppression during hypothermic circulatory arrest in humans. Ann Thorac Surg 67:1895–1899. (discussion 919–921)
Bro-Jeppesen J, Kjaergaard J, Wanscher M et al (2014) The inflammatory response after out-of-hospital cardiac arrest is not modified by targeted temperature management at 33 degrees C or 36 degrees C. Resuscitation 85:1480–1487
Hypothermia after Cardiac Arrest Study Group (2002) Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N Engl J Med 346:549–556
Bernard SA, Gray TW, Buist MD et al (2002) Treatment of comatose survivors of out-of-hospital cardiac arrest with induced hypothermia. N Engl J Med 346:557–563
Dumas F, Grimaldi D, Zuber B et al (2011) Is hypothermia after cardiac arrest effective in both shockable and nonshockable patients?: insights from a large registry. Circulation 123:877–886
Testori C, Sterz F, Behringer W et al (2011) Mild therapeutic hypothermia is associated with favourable outcome in patients after cardiac arrest with non-shockable rhythms. Resuscitation 82:1162–1167
Vaahersalo J, Hiltunen P, Tiainen M et al (2013) Therapeutic hypothermia after out-of-hospital cardiac arrest in Finnish intensive care units: the FINNRESUSCI study. Intensive Care Med 39:826–837
Mader TJ, Nathanson BH, Soares WE 3rd, Coute RA, McNally BF (2014) Comparative effectiveness of therapeutic hypothermia after out-of-hospital cardiac arrest: insight from a large data registry. Ther Hypothermia Temp Manag 4:21–31
Nichol G, Huszti E, Kim F et al (2013) Does induction of hypothermia improve outcomes after in-hospital cardiac arrest? Resuscitation 84:620–625
Annborn M, Bro-Jeppesen J, Nielsen N et al (2014) The association of targeted temperature management at 33 and 36 degrees C with outcome in patients with moderate shock on admission after out-of-hospital cardiac arrest: a post hoc analysis of the target temperature management trial. Intensive Care Med 40:1210–1219
Yokoyama H, Nagao K, Hase M et al (2011) Impact of therapeutic hypothermia in the treatment of patients with out-of-hospital cardiac arrest from the J-PULSE-HYPO study registry. Circ J 75:1063–1070
Lee BK, Lee SJ, Jeung KW, Lee HY, Heo T, Min YI (2014) Outcome and adverse events with 72-hour cooling at 32 degrees C as compared to 24-hour cooling at 33 degrees C in comatose asphyxial arrest survivors. Am J Emerg Med 32:297–301
Nielsen N, Friberg H (2015) Temperature management after cardiac arrest. Curr Opin Crit Care 21:202–208
Nolan JP, Morley PT, Vanden Hoek TL, Hickey RW (2003) Therapeutic hypothermia after cardiac arrest. An advisory statement by the advancement life support task force of the international liaison committee on resuscitation. Resuscitation 57:231–235
Kuboyama K, Safar P, Radovsky A et al (1993) Delay in cooling negates the beneficial effect of mild resuscitative cerebral hypothermia after cardia arrest in dogs: a prospective, randomized study. Crit Care Med 21:1348–1358
Colbourne F, Corbett D (1995) Delayed postischemic hypothermia: a six month survival study using behavioral and histological assessments of neuroprotection. J Neurosci 15:7250–7260
Haugk M, Testori C, Sterz F et al (2011) Relationship between time to target temperature and outcome in patients treated with therapeutic hypothermia after cardiac arrest. Crit Care 15:R101
Benz-Woerner J, Delodder F, Benz R et al (2012) Body temperature regulation and outcome after cardiac arrest and therapeutic hypothermia. Resuscitation 83:338–342
Perman SM, Ellenberg JH, Grossestreuer AV et al (2015) Shorter time to target temperature is associated with poor neurologic outcome in post-arrest patients treated with targeted temperature management. Resuscitation 88:114–119
Kim F, Olsufka M, Longstreth WT Jr et al (2007) Pilot randomized clinical trial of prehospital induction of mild hypothermia in out-of-hospital cardiac arrest patients with a rapid infusion of 4 degrees C normal saline. Circulation 115:3064–3070
Kamarainen A, Virkkunen I, Tenhunen J, Yli-Hankala A, Silfvast T (2009) Prehospital therapeutic hypothermia for comatose survivors of cardiac arrest: a randomized controlled trial. Acta Anaesthesiol Scand 53:900–907
Bernard SA, Smith K, Cameron P et al (2010) Induction of therapeutic hypothermia by paramedics after resuscitation from out-of-hospital ventricular fibrillation cardiac arrest: a randomized controlled trial. Circulation 122:737–742
Kim F, Nichol G, Maynard C et al (2014) Effect of prehospital induction of mild hypothermia on survival and neurological status among adults with cardiac arrest: a randomized clinical trial. JAMA 311:45–52
Debaty G, Maignan M, Savary D et al (2014) Impact of intra-arrest therapeutic hypothermia in outcomes of prehospital cardiac arrest: a randomized controlled trial. Intensive Care Med 40:1832–1842
Castren M, Nordberg P, Svensson L et al (2010) Intra-arrest transnasal evaporative cooling: a randomized, prehospital, multicenter study (PRINCE: Pre-ROSC IntraNasal Cooling Effectiveness). Circulation 122:729–736
Polderman KH, Herold I (2009) Therapeutic hypothermia and controlled normothermia in the intensive care unit: practical considerations, side effects, and cooling methods. Crit Care Med 37:1101–1120
Bernard SA, Smith K, Cameron P et al (2012) Induction of prehospital therapeutic hypothermia after resuscitation from nonventricular fibrillation cardiac arrest*. Crit Care Med 40:747–753
Bernard SA, Jones BM, Horne MK (1997) Clinical trial of induced hypothermia in comatose survivors of out-of-hospital cardiac arrest. Ann Emerg Med 30:146–153
Busch M, Soreide E, Lossius HM, Lexow K, Dickstein K (2006) Rapid implementation of therapeutic hypothermia in comatose out-of-hospital cardiac arrest survivors. Acta Anaesthesiol Scand 50:1277–1283
Belliard G, Catez E, Charron C et al (2007) Efficacy of therapeutic hypothermia after out-of-hospital cardiac arrest due to ventricular fibrillation. Resuscitation 75:252–259
Aberle J, Kluge S, Prohl J et al (2006) Hypothermia after CPR through conduction and convection – Initial experience on an ICU. Intensivmed Notfmed 43:37–43
Feuchtl A et al (2007) Endovascular cooling improves neurological short-term outcome after prehospital cardiac arrest. Intensivmed 44:37–42
Fries M, Stoppe C, Brucken D, Rossaint R, Kuhlen R (2009) Influence of mild therapeutic hypothermia on the inflammatory response after successful resuscitation from cardiac arrest. J Crit Care 24:453–457
Larsson IM, Wallin E, Rubertsson S (2010) Cold saline infusion and ice packs alone are effective in inducing and maintaining therapeutic hypothermia after cardiac arrest. Resuscitation 81:15–19
Skulec R, Kovarnik T, Dostalova G, Kolar J, Linhart A (2008) Induction of mild hypothermia in cardiac arrest survivors presenting with cardiogenic shock syndrome. Acta Anaesthesiol Scand 52:188–194
Kliegel A, Janata A, Wandaller C et al (2007) Cold infusions alone are effective for induction of therapeutic hypothermia but do not keep patients cool after cardiac arrest. Resuscitation 73:46–53
Benson DW, Williams GR Jr, Spencer FC, Yates AJ (1959) The use of hypothermia after cardiac arrest. Anesth Analg 38:423–428
Yanagawa Y, Ishihara S, Norio H et al (1998) Preliminary clinical outcome study of mild resuscitative hypothermia after out-of-hospital cardiopulmonary arrest. Resuscitation 39:61–66
Damian MS, Ellenberg D, Gildemeister R et al (2004) Coenzyme Q10 combined with mild hypothermia after cardiac arrest: a preliminary study. Circulation 110:3011–3016
Hay AW, Swann DG, Bell K, Walsh TS, Cook B (2008) Therapeutic hypothermia in comatose patients after out-of-hospital cardiac arrest. Anaesthesia 63:15–19
Zeiner A, Holzer M, Sterz F et al (2000) Mild resuscitative hypothermia to improve neurological outcome after cardiac arrest. A clinical feasibility trial. Hypothermia After Cardiac Arrest (HACA) study group. Stroke 31:86–94
Hoedemaekers CW, Ezzahti M, Gerritsen A, van der Hoeven JG (2007) Comparison of cooling methods to induce and maintain normo- and hypothermia in intensive care unit patients: a prospective intervention study. Crit Care 11:R91
Uray T, Malzer R (2008) Out-of-hospital surface cooling to induce mild hypothermia in human cardiac arrest: a feasibility trial. Resuscitation 77:331–338
Arrich J (2007) Clinical application of mild therapeutic hypothermia after cardiac arrest. Crit Care Med 35:1041–1047
Castrejon S, Cortes M, Salto ML et al (2009) Improved prognosis after using mild hypothermia to treat cardiorespiratory arrest due to a cardiac cause: comparison with a control group. Rev Esp Cardiol 62:733–741
Don CW, Longstreth WT Jr, Maynard C et al (2009) Active surface cooling protocol to induce mild therapeutic hypothermia after out-of-hospital cardiac arrest: a retrospective before-and-after comparison in a single hospital. Crit Care Med 37:3062–3069
Felberg RA, Krieger DW, Chuang R et al (2001) Hypothermia after cardiac arrest: feasibility and safety of an external cooling protocol. Circulation 104:1799–1804
Flint AC, Hemphill JC, Bonovich DC (2007) Therapeutic hypothermia after cardiac arrest: performance characteristics and safety of surface cooling with or without endovascular cooling. Neurocrit Care 7:109–118
Heard KJ, Peberdy MA, Sayre MR et al (2010) A randomized controlled trial comparing the Arctic Sun to standard cooling for induction of hypothermia after cardiac arrest. Resuscitation 81:9–14
Merchant RM, Abella BS, Peberdy MA et al (2006) Therapeutic hypothermia after cardiac arrest: unintentional overcooling is common using ice packs and conventional cooling blankets. Crit Care Med 34:S490–S494
Haugk M, Sterz F, Grassberger M et al (2007) Feasibility and efficacy of a new non-invasive surface cooling device in post-resuscitation intensive care medicine. Resuscitation 75:76–81
Kilgannon JH, Roberts BW, Stauss M et al (2008) Use of a standardized order set for achieving target temperature in the implementation of therapeutic hypothermia after cardiac arrest: a feasibility study. Acad Emerg Med 15:499–505
Scott BD, Hogue T, Fixley MS, Adamson PB (2006) Induced hypothermia following out-of-hospital cardiac arrest; initial experience in a community hospital. Clin Cardiol 29:525–529
Storm C, Steffen I, Schefold JC et al (2008) Mild therapeutic hypothermia shortens intensive care unit stay of survivors after out-of-hospital cardiac arrest compared to historical controls. Crit Care 12:R78
Nordberg P, Taccone FS, Castren M et al (2013) Design of the PRINCESS trial: pre-hospital resuscitation intra-nasal cooling effectiveness survival study (PRINCESS). BMC Emerg Med 13:21
Al-Senani FM, Graffagnino C, Grotta JC et al (2004) A prospective, multicenter pilot study to evaluate the feasibility and safety of using the coolgard system and icy catheter following cardiac arrest. Resuscitation 62:143–150
Holzer M, Mullner M, Sterz F et al (2006) Efficacy and safety of endovascular cooling after cardiac arrest: cohort study and Bayesian approach. Stroke 37:1792–1797
Kliegel A, Losert H, Sterz F et al (2005) Cold simple intravenous infusions preceding special endovascular cooling for faster induction of mild hypothermia after cardiac arrest–a feasibility study. Resuscitation 64:347–351
Pichon N, Amiel JB, Francois B, Dugard A, Etchecopar C, Vignon P (2007) Efficacy of and tolerance to mild induced hypothermia after out-of-hospital cardiac arrest using an endovascular cooling system. Crit Care 11:R71
Spiel AO, Kliegel A, Janata A et al (2009) Hemostasis in cardiac arrest patients treated with mild hypothermia initiated by cold fluids. Resuscitation 80:762–765
Wolff B, Machill K, Schumacher D, Schulzki I, Werner D (2009) Early achievement of mild therapeutic hypothermia and the neurologic outcome after cardiac arrest. Int J Cardiol 133:223–228
Nagao K, Kikushima K, Watanabe K et al (2010) Early induction of hypothermia during cardiac arrest improves neurological outcomes in patients with out-of-hospital cardiac arrest who undergo emergency cardiopulmonary bypass and percutaneous coronary intervention. Circ J 74:77–85
Stub D, Bernard S, Pellegrino V et al (2015) Refractory cardiac arrest treated with mechanical CPR, hypothermia, ECMO and early reperfusion (the CHEER trial). Resuscitation 86:88–94
Mahmood MA, Zweifler RM (2007) Progress in shivering control. J Neurol Sci 261:47–54
Wadhwa A, Sengupta P, Durrani J et al (2005) Magnesium sulphate only slightly reduces the shivering threshold in humans. Br J Anaesth 94:756–762
Gillies MA, Pratt R, Whiteley C, Borg J, Beale RJ, Tibby SM (2010) Therapeutic hypothermia after cardiac arrest: a retrospective comparison of surface and endovascular cooling techniques. Resuscitation 81:1117–1122
Knapik P, Rychlik W, Duda D, Golyszny R, Borowik D, Ciesla D (2012) Relationship between blood, nasopharyngeal and urinary bladder temperature during intravascular cooling for therapeutic hypothermia after cardiac arrest. Resuscitation 83:208–212
Shin J, Kim J, Song K, Kwak Y (2013) Core temperature measurement in therapeutic hypothermia according to different phases: comparison of bladder, rectal, and tympanic versus pulmonary artery methods. Resuscitation 84:810–817
Tomte O, Draegni T, Mangschau A, Jacobsen D, Auestad B, Sunde K (2011) A comparison of intravascular and surface cooling techniques in comatose cardiac arrest survivors. Crit Care Med 39:443–449
Nair SU, Lundbye JB (2013) The occurrence of shivering in cardiac arrest survivors undergoing therapeutic hypothermia is associated with a good neurologic outcome. Resuscitation 84:626–629
Polderman KH, Peerdeman SM, Girbes AR (2001) Hypophosphatemia and hypomagnesemia induced by cooling in patients with severe head injury. J Neurosurg 94:697–705
Brinkman AC, Ten Tusscher BL, de Waard MC, de Man FR, Girbes AR, Beishuizen A (2014) Minimal effects on ex vivo coagulation during mild therapeutic hypothermia in post cardiac arrest patients. Resuscitation 85:1359–1363
Perbet S, Mongardon N, Dumas F et al (2011) Early-onset pneumonia after cardiac arrest: characteristics, risk factors and influence on prognosis. Am J Respir Crit Care Med 184:1048–1054
Mongardon N, Perbet S, Lemiale V et al (2011) Infectious complications in out-of-hospital cardiac arrest patients in the therapeutic hypothermia era. Crit Care Med 39:1359–1364
Gagnon DJ, Nielsen N, Fraser GL et al (2015) Prophylactic antibiotics are associated with a lower incidence of pneumonia in cardiac arrest survivors treated with targeted temperature management. Resuscitation 92:154–159
Davies KJ, Walters JH, Kerslake IM, Greenwood R, Thomas MJ (2013) Early antibiotics improve survival following out-of hospital cardiac arrest. Resuscitation 84:616–619
Tortorici MA, Kochanek PM, Poloyac SM (2007) Effects of hypothermia on drug disposition, metabolism, and response: a focus of hypothermia-mediated alterations on the cytochrome P450 enzyme system. Crit Care Med 35:2196–2204
Schmidt-Schweda S, Ohler A, Post H, Pieske B (2013) Moderate hypothermia for severe cardiogenic shock (COOL Shock Study I & II). Resuscitation 84:319–325
Zobel C, Adler C, Kranz A et al (2012) Mild therapeutic hypothermia in cardiogenic shock syndrome. Crit Care Med 40:1715–1723
Jacobshagen C, Pelster T, Pax A et al (2010) Effects of mild hypothermia on hemodynamics in cardiac arrest survivors and isolated failing human myocardium. Clin Res Cardiol 99:267–276
Grafton ST, Longstreth WT Jr (1988) Steroids after cardiac arrest: a retrospective study with concurrent, nonrandomized controls. Neurology 38:1315–1316
Gueugniaud PY, Gaussorgues P, Garcia-Darennes F et al (1990) Early effects of nimodipine on intracranial and cerebral perfusion pressures in cerebral anoxia after out-of-hospital cardiac arrest. Resuscitation 20:203–212
Roine RO, Kaste M, Kinnunen A, Nikki P, Sarna S, Kajaste S (1990) Nimodipine after resuscitation from out-of-hospital ventricular fibrillation: a placebo-controlled, double-blind, randomized trial. JAMA 264:3171–3177
o A (1991) A randomized clinical study of a calcium-entry blocker (lidoflazine) in the treatment of comatose survivors of cardiac arrest. Brain resuscitation clinical trial ii study group. N Engl J Med 324:1225–1231
Arola OJ, Laitio RM, Roine RO et al (2013) Feasibility and cardiac safety of inhaled xenon in combination with therapeutic hypothermia following out-of-hospital cardiac arrest. Crit Care Med 41:2116–2124
Sandroni C, Cariou A, Cavallaro F et al (2014) Prognostication in comatose survivors of cardiac arrest: an advisory statement from the European resuscitation council and the European society of intensive care medicine. Resuscitation 85:1779–1789
Stiell IG, Nichol G, Leroux BG et al (2011) Early versus later rhythm analysis in patients with out-of-hospital cardiac arrest. N Engl J Med 365:787–797
Sandroni C, Cavallaro F, Callaway CW et al (2013) Predictors of poor neurological outcome in adult comatose survivors of cardiac arrest: a systematic review and meta-analysis. Part 2: patients treated with therapeutic hypothermia. Resuscitation 84:1324–1338
Sandroni C, Cavallaro F, Callaway CW et al (2013) Predictors of poor neurological outcome in adult comatose survivors of cardiac arrest: a systematic review and meta-analysis. Part 1: patients not treated with therapeutic hypothermia. Resuscitation 84:1310–1323
Geocadin RG, Peberdy MA, Lazar RM (2012) Poor survival after cardiac arrest resuscitation: a self-fulfilling prophecy or biologic destiny? Crit Care Med 40:979–980
Bertini G, Margheri M, Giglioli C et al (1989) Prognostic significance of early clinical manifestations in postanoxic coma: a retrospective study of 58 patients resuscitated after prehospital cardiac arrest. Crit Care Med 17:627–633
Zandbergen EG, Hijdra A, Koelman JH et al (2006) Prediction of poor outcome within the first 3 days of postanoxic coma. Neurology 66:62–68
Bisschops LL, van Alfen N, Bons S, van der Hoeven JG, Hoedemaekers CW (2011) Predictors of poor neurologic outcome in patients after cardiac arrest treated with hypothermia: a retrospective study. Resuscitation 82:696–701
Bouwes A, Binnekade JM, Zandstra DF et al (2009) Somatosensory evoked potentials during mild hypothermia after cardiopulmonary resuscitation. Neurology 73:1457–1461
Bouwes A, Binnekade JM, Kuiper MA et al (2012) Prognosis of coma after therapeutic hypothermia: a prospective cohort study. Ann Neurol 71:206–212
Fugate JE, Wijdicks EF, Mandrekar J et al (2010) Predictors of neurologic outcome in hypothermia after cardiac arrest. Ann Neurol 68:907–914
Choi SP, Youn CS, Park KN et al (2012) Therapeutic hypothermia in adult cardiac arrest because of drowning. Acta Anaesthesiol Scand 56:116–123
Wu O, Batista LM, Lima FO; Vangel MG, Furie KL, Greer DM (2011) Predicting clinical outcome in comatose cardiac arrest patients using early noncontrast computed tomography. Stroke 42:985–992
Greer DM, Yang J, Scripko PD et al (2013) Clinical examination for prognostication in comatose cardiac arrest patients. Resuscitation 84:1546–1551
Dragancea I, Horn J, Kuiper M et al (2015) Neurological prognostication after cardiac arrest and targeted temperature management 33 degrees C versus 36 degrees C: results from a randomised controlled clinical trial. Resuscitation 93:164–170
Topcuoglu MA, Oguz KK, Buyukserbetci G, Bulut E (2009) Prognostic value of magnetic resonance imaging in post-resuscitation encephalopathy. Intern Med 48:1635–1645
Rossetti AO, Oddo M, Logroscino G, Kaplan PW (2010) Prognostication after cardiac arrest and hypothermia: a prospective study. Ann Neurol 67:301–307
Rossetti AO, Urbano LA, Delodder F, Kaplan PW, Oddo M (2010) Prognostic value of continuous EEG monitoring during therapeutic hypothermia after cardiac arrest. Crit Care 14:R173
Rossetti AO, Carrera E, Oddo M (2012) Early EEG correlates of neuronal injury after brain anoxia. Neurology 78:796–802
Krumholz A, Stern BJ, Weiss HD (1988) Outcome from coma after cardiopulmonary resuscitation: relation to seizures and myoclonus. Neurology 38:401–405
Wijdicks EF, Young GB (1994) Myoclonus status in comatose patients after cardiac arrest. Lancet 343:1642–1643
Rittenberger JC, Popescu A, Brenner RP, Guyette FX, Callaway CW (2012) Frequency and timing of nonconvulsive status epilepticus in comatose post-cardiac arrest subjects treated with hypothermia. Neurocrit Care 16:114–122
Accardo J, De Lisi D, Lazzerini P, Primavera A (2013) Good functional outcome after prolonged postanoxic comatose myoclonic status epilepticus in a patient who had undergone bone marrow transplantation. Case Rep Neurol Med 2013:872127
Arnoldus EP, Lammers GJ (1995) Postanoxic coma: good recovery despite myoclonus status. Ann Neurol 38:697–698
Datta S, Hart GK, Opdam H, Gutteridge G, Archer J (2009) Post-hypoxic myoclonic status: the prognosis is not always hopeless. Crit Care Resusc 11:39–41
English WA, Giffin NJ, Nolan JP (2009) Myoclonus after cardiac arrest: pitfalls in diagnosis and prognosis. Anaesthesia 64:908–911
Goh WC, Heath PD, Ellis SJ, Oakley PA (2002) Neurological outcome prediction in a cardiorespiratory arrest survivor. Br J Anaesth 88:719–722
Morris HR, Howard RS, Brown P (1998) Early myoclonic status and outcome after cardiorespiratory arrest. J Neurol Neurosurg Psychiatry 64:267–268
Greer DM (2013) Unexpected good recovery in a comatose post-cardiac arrest patient with poor prognostic features. Resuscitation 84:e81–e82
Lucas JM, Cocchi MN, Salciccioli J et al (2012) Neurologic recovery after therapeutic hypothermia in patients with post-cardiac arrest myoclonus. Resuscitation 83:265–269
Stelzl T, von Bose MJ, Hogl B, Fuchs HH, Flugel KA (1995) A comparison of the prognostic value of neuron-specific enolase serum levels and somatosensory evoked potentials in 13 reanimated patients. Eur J Emerg Med 2:24–27
Tiainen M, Kovala TT, Takkunen OS, Roine RO (2005) Somatosensory and brainstem auditory evoked potentials in cardiac arrest patients treated with hypothermia. Crit Care Med 33:1736–1740
Zingler VC, Krumm B, Bertsch T, Fassbender K, Pohlmann-Eden B (2003) Early prediction of neurological outcome after cardiopulmonary resuscitation: a multimodal approach combining neurobiochemical and electrophysiological investigations may provide high prognostic certainty in patients after cardiac arrest. Eur Neurol 49:79–84
Rothstein TL (2000) The role of evoked potentials in anoxic-ischemic coma and severe brain trauma. J Clin Neurophysiol 17:486–497
Zanatta P, Messerotti Benvenuti S, Baldanzi F, Bosco E (2012) Pain-related middle-latency somatosensory evoked potentials in the prognosis of post anoxic coma: a preliminary report. Minerva Anestesiol 78:749–756
Young GB, Doig G, Ragazzoni A (2005) Anoxic-ischemic encephalopathy: clinical and electrophysiological associations with outcome. Neurocrit Care 2:159–164
Cloostermans MC, van Meulen FB, Eertman CJ, Hom HW, van Putten MJ (2012) Continuous electroencephalography monitoring for early prediction of neurological outcome in postanoxic patients after cardiac arrest: a prospective cohort study. Crit Care Med 40:2867–2875
Zandbergen EG, Hijdra A, de Haan RJ et al (2006) Interobserver variation in the interpretation of SSEPs in anoxic-ischaemic coma. Clin Neurophysiol 117:1529–1535
Pfeifer R, Weitzel S, Gunther A et al (2013) Investigation of the inter-observer variability effect on the prognostic value of somatosensory evoked potentials of the median nerve (SSEP) in cardiac arrest survivors using an SSEP classification. Resuscitation 84:1375–1381
Geocadin RG, Buitrago MM, Torbey MT, Chandra-Strobos N, Williams MA, Kaplan PW (2006) Neurologic prognosis and withdrawal of life support after resuscitation from cardiac arrest. Neurology 67:105–108
Crepeau AZ, Rabinstein AA, Fugate JE et al (2013) Continuous EEG in therapeutic hypothermia after cardiac arrest: prognostic and clinical value. Neurology 80:339–344
Oddo M, Rossetti AO (2014) Early multimodal outcome prediction after cardiac arrest in patients treated with hypothermia. Crit Care Med 42:1340–1347
Westhall E, Rosen I, Rossetti AO et al (2015) Interrater variability of EEG interpretation in comatose cardiac arrest patients. Clin Neurophysiol. doi:10.1016/j.clinph.2015.03.017. (pii: S1388-2457(15)00235-7)
Wennervirta JE, Ermes MJ, Tiainen SM et al (2009) Hypothermia-treated cardiac arrest patients with good neurological outcome differ early in quantitative variables of EEG suppression and epileptiform activity. Crit Care Med 37:2427–2435
Rossetti AO, Oddo M, Liaudet L, Kaplan PW (2009) Predictors of awakening from postanoxic status epilepticus after therapeutic hypothermia. Neurology 72:744–749
Kawai M, Thapalia U, Verma A (2011) Outcome from therapeutic hypothermia and EEG. J Clin Neurophysiol 28:483–488
Oh SH, Park KN, Kim YM et al (2012) The prognostic value of continuous amplitude-integrated electroencephalogram applied immediately after return of spontaneous circulation in therapeutic hypothermia-treated cardiac arrest patients. Resuscitation 84:200–205
Hofmeijer J, Tjepkema-Cloostermans MC, van Putten MJ (2014) Burst-suppression with identical bursts: a distinct EEG pattern with poor outcome in postanoxic coma. Clin Neurophysiol 125:947–954
Claassen J, Taccone FS, Horn P, Holtkamp M, Stocchetti N, Oddo M (2013) Recommendations on the use of EEG monitoring in critically ill patients: consensus statement from the neurointensive care section of the ESICM. Intensive Care Med 39:1337–1351
Bottiger BW, Mobes S, Glatzer R et al (2001) Astroglial protein S-100 is an early and sensitive marker of hypoxic brain damage and outcome after cardiac arrest in humans. Circulation 103:2694–2698
Rosen H, Sunnerhagen KS, Herlitz J, Blomstrand C, Rosengren L (2001) Serum levels of the brain-derived proteins S-100 and NSE predict long-term outcome after cardiac arrest. Resuscitation 49:183–191
Steffen IG, Hasper D, Ploner CJ et al (2010) Mild therapeutic hypothermia alters neuron specific enolase as an outcome predictor after resuscitation: 97 prospective hypothermia patients compared to 133 historical non-hypothermia patients. Crit Care 14:R69
Kim J, Choi BS, Kim K et al (2012) Prognostic performance of diffusion-weighted MRI combined with NSE in comatose cardiac arrest survivors treated with mild hypothermia. Neurocrit Care 17:412–420
Oksanen T, Tiainen M, Skrifvars MB et al (2009) Predictive power of serum NSE and OHCA score regarding 6-month neurologic outcome after out-of-hospital ventricular fibrillation and therapeutic hypothermia. Resuscitation 80:165–170
Rundgren M, Karlsson T, Nielsen N, Cronberg T, Johnsson P, Friberg H (2009) Neuron specific enolase and S-100B as predictors of outcome after cardiac arrest and induced hypothermia. Resuscitation 80:784–789
Lee BK, Jeung KW, Lee HY, Jung YH, Lee DH (2013) Combining brain computed tomography and serum neuron specific enolase improves the prognostic performance compared to either alone in comatose cardiac arrest survivors treated with therapeutic hypothermia. Resuscitation 84:1387–1392
Zellner T, Gartner R, Schopohl J, Angstwurm M (2013) NSE and S-100B are not sufficiently predictive of neurologic outcome after therapeutic hypothermia for cardiac arrest. Resuscitation 84:1382–1386
Storm C, Nee J, Jorres A, Leithner C, Hasper D, Ploner CJ (2012) Serial measurement of neuron specific enolase improves prognostication in cardiac arrest patients treated with hypothermia: a prospective study. Scand J Trauma Resusc Emerg Med 20:6
Tiainen M, Roine RO, Pettila V, Takkunen O (2003) Serum neuron-specific enolase and S-100B protein in cardiac arrest patients treated with hypothermia. Stroke 34:2881–2886
Cronberg T, Rundgren M, Westhall E et al (2011) Neuron-specific enolase correlates with other prognostic markers after cardiac arrest. Neurology 77:623–630
Bloomfield SM, McKinney J, Smith L, Brisman J (2007) Reliability of S100B in predicting severity of central nervous system injury. Neurocrit Care 6:121–138
Stern P, Bartos V, Uhrova J et al (2007) Performance characteristics of seven neuron-specific enolase assays. Tumour Biol 28:84–92
Rundgren M, Cronberg T, Friberg H, Isaksson A (2014) Serum neuron specific enolase – impact of storage and measuring method. BMC Res Notes 7:726
Johnsson P, Blomquist S, Luhrs C et al (2000) Neuron-specific enolase increases in plasma during and immediately after extracorporeal circulation. Ann Thorac Surg 69:750–754
Huntgeburth M, Adler C, Rosenkranz S et al (2014) Changes in neuron-specific enolase are more suitable than its absolute serum levels for the prediction of neurologic outcome in hypothermia-treated patients with out-of-hospital cardiac arrest. Neurocrit Care 20:358–366
Stammet P, Collignon O, Hassager C et al (2015) Neuron-specific enolase as a predictor of death or poor neurological outcome after out-of-hospital cardiac arrest and targeted temperature management at 33 degrees c and 36 degrees C. J Am Coll Cardiol 65:2104–2114
Kim SH, Choi SP, Park KN, Youn CS, Oh SH, Choi SM (2013) Early brain computed tomography findings are associated with outcome in patients treated with therapeutic hypothermia after out-of-hospital cardiac arrest. Scand J Trauma Resusc Emerg Med 21:57
Els T, Kassubek J, Kubalek R, Klisch J (2004) Diffusion-weighted MRI during early global cerebral hypoxia: a predictor for clinical outcome? Acta Neurol Scand 110:361–367
Mlynash M, Campbell DM, Leproust EM et al (2010) Temporal and spatial profile of brain diffusion-weighted MRI after cardiac arrest. Stroke 41:1665–1672
Wijdicks EF, Campeau NG, Miller GM (2001) MR imaging in comatose survivors of cardiac resuscitation. AJNR Am J Neuroradiol 22:1561–1565
Wu O, Sorensen AG, Benner T, Singhal AB, Furie KL, Greer DM (2009) Comatose patients with cardiac arrest: predicting clinical outcome with diffusion-weighted MR imaging. Radiology 252:173–181
Wijman CA, Mlynash M, Caulfield AF et al (2009) Prognostic value of brain diffusion-weighted imaging after cardiac arrest. Ann Neurol 65:394–402
Choi SP, Park KN, Park HK et al (2010) Diffusion-weighted magnetic resonance imaging for predicting the clinical outcome of comatose survivors after cardiac arrest: a cohort study. Crit Care 14:R17
Kim J, Kim K, Hong S et al (2013) Low apparent diffusion coefficient cluster-based analysis of diffusion-weighted MRI for prognostication of out-of-hospital cardiac arrest survivors. Resuscitation 84:1393–1399
Sharshar T, Citerio G, Andrews PJ et al (2014) Neurological examination of critically ill patients: a pragmatic approach. Report of an ESICM expert panel. Intensive Care Med 40:484–495
Jorgensen EO, Holm S (1998) The natural course of neurological recovery following cardiopulmonary resuscitation. Resuscitation 36:111–122
Cronberg T, Brizzi M, Liedholm LJ et al (2013) Neurological prognostication after cardiac arrest–recommendations from the Swedish resuscitation council. Resuscitation 84:867–872
Taccone FS, Cronberg T, Friberg H et al (2014) How to assess prognosis after cardiac arrest and therapeutic hypothermia. Crit Care 18:202
Stammet P, Wagner DR, Gilson G, Devaux Y (2013) Modeling serum level of s100beta and bispectral index to predict outcome after cardiac arrest. J Am Coll Cardiol 62:851–858
Al Thenayan E, Savard M, Sharpe M, Norton L, Young B (2008) Predictors of poor neurologic outcome after induced mild hypothermia following cardiac arrest. Neurology 71:1535–1537
Grossestreuer AV, Abella BS, Leary M et al (2013) Time to awakening and neurologic outcome in therapeutic hypothermia-treated cardiac arrest patients. Resuscitation 84:1741–1746
Gold B, Puertas L, Davis SP et al (2014) Awakening after cardiac arrest and post resuscitation hypothermia: are we pulling the plug too early? Resuscitation 85:211–214
Krumnikl JJ, Bottiger BW, Strittmatter HJ, Motsch J (2002) Complete recovery after 2 h of cardiopulmonary resuscitation following high-dose prostaglandin treatment for atonic uterine haemorrhage. Acta Anaesthesiol Scand 46:1168–1170
Smith K, Andrew E, Lijovic M, Nehme Z, Bernard S (2015) Quality of life and functional outcomes 12 months after out-of-hospital cardiac arrest. Circulation 131:174–181
Phelps R, Dumas F, Maynard C, Silver J, Rea T (2013) Cerebral performance category and long-term prognosis following out-of-hospital cardiac arrest. Crit Care Med 41:1252–1257
Wilder Schaaf KP, Artman LK, Peberdy MA et al (2013) Anxiety, depression, and PTSD following cardiac arrest: a systematic review of the literature. Resuscitation 84:873–877
Wachelder EM, Moulaert VR, van Heugten C, Verbunt JA, Bekkers SC, Wade DT (2009) Life after survival: long-term daily functioning and quality of life after an out-of-hospital cardiac arrest. Resuscitation 80:517–522
Cronberg T, Lilja G, Rundgren M, Friberg H, Widner H (2009) Long-term neurological outcome after cardiac arrest and therapeutic hypothermia. Resuscitation 80:1119–1123
Torgersen J, Strand K, Bjelland TW et al (2010) Cognitive dysfunction and health-related quality of life after a cardiac arrest and therapeutic hypothermia. Acta Anaesthesiol Scand 54:721–728
Mateen FJ, Josephs KA, Trenerry MR et al (2011) Long-term cognitive outcomes following out-of-hospital cardiac arrest: a population-based study. Neurology 77:1438–1445
Kragholm K, Wissenberg M, Mortensen RN et al (2015) Return to work in out-of-hospital cardiac arrest survivors: a nationwide register-based follow-up study. Circulation 131:1682–1690
Cobbe SM, Dalziel K, Ford I, Marsden AK (1996) Survival of 1476 patients initially resuscitated from out of hospital cardiac arrest. BMJ 312:1633–1637
Kamphuis HC, De Leeuw JR, Derksen R, Hauer R, Winnubst JA (2002) A 12-month quality of life assessment of cardiac arrest survivors treated with or without an implantable cardioverter defibrillator. Europace 4:417–425
Gamper G, Willeit M, Sterz F et al (2004) Life after death: posttraumatic stress disorder in survivors of cardiac arrest–prevalence, associated factors, and the influence of sedation and analgesia. Crit Care Med 32:378–383
Pusswald G, Fertl E, Faltl M, Auff E (2000) Neurological rehabilitation of severely disabled cardiac arrest survivors. Part II. Life situation of patients and families after treatment. Resuscitation 47:241–248
Dougherty CM, Benoliel JQ, Bellin C (2000) Domains of nursing intervention after sudden cardiac arrest and automatic internal cardioverter defibrillator implantation. Heart Lung 29:79–86
Brown JP, Clark AM, Dalal H, Welch K, Taylor RS (2011) Patient education in the management of coronary heart disease. Cochrane Database Syst Rev (12):CD008895
Lundgren-Nilsson A, Rosen H, Hofgren C, Sunnerhagen KS (2005) The first year after successful cardiac resuscitation: function, activity, participation and quality of life. Resuscitation 66:285–289
Moulaert VR, Wachelder EM, Verbunt JA, Wade DT, van Heugten CM (2010) Determinants of quality of life in survivors of cardiac arrest. J Rehabil Med 42:553–558
Cowan MJ, Pike KC, Budzynski HK (2001) Psychosocial nursing therapy following sudden cardiac arrest: impact on two-year survival. Nurs Res 50:68–76
Dougherty CM, Lewis FM, Thompson EA, Baer JD, Kim W (2004) Short-term efficacy of a telephone intervention by expert nurses after an implantable cardioverter defibrillator. Pacing Clin Electrophysiol 27:1594–1602
Dougherty CM, Thompson EA, Lewis FM (2005) Long-term outcomes of a telephone intervention after an ICD. Pacing Clin Electrophysiol 28:1157–1167
Dougherty CM, Pyper GP, Frasz HA (2004) Description of a nursing intervention program after an implantable cardioverter defibrillator. Heart Lung 33:183–190
Moulaert VR, van Heugten CM, Winkens B et al (2015) Early neurologically-focused follow-up after cardiac arrest improves quality of life at one year: a randomised controlled trial. Int J Cardiol 193:8–16
Moulaert VR, Verbunt JA, Bakx WG et al (2011) ‚Stand still…, and move on‘, a new early intervention service for cardiac arrest survivors and their caregivers: rationale and description of the intervention. Clin Rehabil 25:867–879
Moulaert VR, van Haastregt JC, Wade DT, van Heugten CM, Verbunt JA (2014) ‚Stand still…, and move on‘, an early neurologically-focused follow-up for cardiac arrest survivors and their caregivers: a process evaluation. BMC Health Serv Res 14:34
van Heugten C, Rasquin S, Winkens I, Beusmans G, Verhey F (2007) Checklist for cognitive and emotional consequences following stroke (CLCE-24): development, usability and quality of the self-report version. Clin Neurol Neurosurg 109:257–262
Cicerone KD, Langenbahn DM, Braden C et al (2011) Evidence-based cognitive rehabilitation: updated review of the literature from 2003 through 2008. Arch Phys Med Rehabil 92:519–530
Spinhoven P, Ormel J, Sloekers PP, Kempen GI, Speckens AE, Van Hemert AM (1997) A validation study of the Hospital Anxiety and Depression Scale (HADS) in different groups of Dutch subjects. Psychol Med 27:363–370
van der Ploeg E, Mooren TT, Kleber RJ, van der Velden PG, Brom D (2004) Construct validation of the Dutch version of the impact of event scale. Psychol Assess 16:16–26
Sandroni C, Adrie C, Cavallaro F et al (2010) Are patients brain-dead after successful resuscitation from cardiac arrest suitable as organ donors? A systematic review. Resuscitation 81:1609–1614
Adrie C, Haouache H, Saleh M et al (2008) An underrecognized source of organ donors: patients with brain death after successfully resuscitated cardiac arrest. Intensive Care Med 34:132–137
Ali AA, Lim E, Thanikachalam M et al (2007) Cardiac arrest in the organ donor does not negatively influence recipient survival after heart transplantation. Eur J Cardiothorac Surg 31:929–933
Orioles A, Morrison WE, Rossano JW et al (2013) An under-recognized benefit of cardiopulmonary resuscitation: organ transplantation. Crit Care Med 41:2794–2799
Quader MA, Wolfe LG, Kasirajan V (2013) Heart transplantation outcomes from cardiac arrest–resuscitated donors. J Heart Lung Transplant 32:1090–1095
Pilarczyk K, Osswald BR, Pizanis N et al (2011) Use of donors who have suffered cardiopulmonary arrest and resuscitation in lung transplantation. Eur J Cardiothorac Surg 39:342–347
Sánchez-Lázaro I, Almenar-Bonet L, Martínez-Dolz L et al (2010) Can we accept donors who have suffered a resuscitated cardiac arrest? Transplant Proc 42:3091–3092 (Elsevier)
Southerland KW, Castleberry AW, Williams JB, Daneshmand MA, Ali AA, Milano CA (2013) Impact of donor cardiac arrest on heart transplantation. Surgery 154:312–319
Castleberry AW, Worni M, Osho AA et al (2013) Use of lung allografts from brain-dead donors after cardiopulmonary arrest and resuscitation. Am J Respir Crit Care Med 188:466–473
Alonso A, Fernandez-Rivera C, Villaverde P et al (2005) Renal transplantation from non-heart-beating donors: a single-center 10-year experience. Transplant Proc 37:3658–3660
Casavilla A, Ramirez C, Shapiro R et al (1995) Experience with liver and kidney allografts from non-heart-beating donors. Transplantation 59:197–203
Nicholson ML, Metcalfe MS, White SA et al (2000) A comparison of the results of renal transplantation from non-heart-beating, conventional cadaveric, and living donors. Kidney Int 58:2585–2591
Fondevila C, Hessheimer AJ, Flores E et al (2012) Applicability and results of Maastricht type 2 donation after cardiac death liver transplantation. Am J Transplant 12:162–170
Otero A, Gomez-Gutierrez M, Suarez F et al (2004) Liver transplantation from maastricht category 2 non-heart-beating donors: a source to increase the donor pool? Transplant Proc 36:747–750
Kootstra G (1995) Statement on non-heart-beating donor programs. Transplant Proc 27:2965
Manara AR, Murphy PG, OʼCallaghan G (2012) Donation after circulatory death. Br J Anaesth 108(Suppl 1):i108–i121
Manara AR, Thomas I (2010) The use of circulatory criteria to diagnose death after unsuccessful cardiopulmonary resuscitation. Resuscitation 81:781–783
Ranthe MF, Winkel BG, Andersen EW et al (2013) Risk of cardiovascular disease in family members of young sudden cardiac death victims. Eur Heart J 34:503–511
Skinner JR (2013) Investigation following resuscitated cardiac arrest. Arch Dis Child 98:66–71
Skinner JR (2012) Investigating sudden unexpected death in the young: a chance to prevent further deaths. Resuscitation 83:1185–1186
Behr ER, Dalageorgou C, Christiansen M et al (2008) Sudden arrhythmic death syndrome: familial evaluation identifies inheritable heart disease in the majority of families. Eur Heart J 29:1670–1680
Engdahl J, Abrahamsson P, Bang A, Lindqvist J, Karlsson T, Herlitz J (2000) Is hospital care of major importance for outcome after out-of-hospital cardiac arrest? Experience acquired from patients with out-of-hospital cardiac arrest resuscitated by the same emergency medical service and admitted to one of two hospitals over a 16-year period in the municipality of Goteborg. Resuscitation 43:201–211
Liu JM, Yang Q, Pirrallo RG, Klein JP, Aufderheide TP (2008) Hospital variability of out-of-hospital cardiac arrest survival. Prehosp Emerg Care 12:339–346
Herlitz J, Engdahl J, Svensson L, Angquist KA, Silfverstolpe J, Holmberg S (2006) Major differences in 1-month survival between hospitals in Sweden among initial survivors of out-of-hospital cardiac arrest. Resuscitation 70:404–409
Callaway CW, Schmicker R, Kampmeyer M et al (2010) Receiving hospital characteristics associated with survival after out-of-hospital cardiac arrest. Resuscitation 81:524–529
Cudnik MT, Sasson C, Rea TD et al (2012) Increasing hospital volume is not associated with improved survival in out of hospital cardiac arrest of cardiac etiology. Resuscitation 83:862–868
Davis DP, Fisher R, Aguilar S et al (2007) The feasibility of a regional cardiac arrest receiving system. Resuscitation 74:44–51
Fothergill RT, Watson LR, Virdi GK, Moore FP, Whitbread M (2014) Survival of resuscitated cardiac arrest patients with ST-elevation myocardial infarction (STEMI) conveyed directly to a heart attack centre by ambulance clinicians. Resuscitation 85:96–98
Hansen M, Fleischman R, Meckler G, Newgard CD (2013) The association between hospital type and mortality among critically ill children in US EDs. Resuscitation 84:488–491
Heffner AC, Pearson DA, Nussbaum ML, Jones AE (2012) Regionalization of post-cardiac arrest care: implementation of a cardiac resuscitation center. Am Heart J 164:493–501e2
Lund-Kordahl I, Olasveengen TM, Lorem T, Samdal M, Wik L, Sunde K (2010) Improving outcome after out-of-hospital cardiac arrest by strengthening weak links of the local chain of survival; quality of advanced life support and post-resuscitation care. Resuscitation 81:422–426
Mooney MR, Unger BT, Boland LL et al (2011) Therapeutic hypothermia after out-of-hospital cardiac arrest: evaluation of a regional system to increase access to cooling. Circulation 124:206–214
Spaite DW, Bobrow BJ, Vadeboncoeur TF et al (2008) The impact of prehospital transport interval on survival in out-of-hospital cardiac arrest: implications for regionalization of post-resuscitation care. Resuscitation 79:61–66
Spaite DW, Stiell IG, Bobrow BJ et al (2009) Effect of transport interval on out-of-hospital cardiac arrest survival in the opals study: implications for triaging patients to specialized cardiac arrest centers. Ann Emerg Med 54(2):248–255
Stub D, Smith K, Bray JE, Bernard S, Duffy SJ, Kaye DM (2011) Hospital characteristics are associated with patient outcomes following out-of-hospital cardiac arrest. Heart 97:1489–1494
Tagami T, Hirata K, Takeshige T et al (2012) Implementation of the fifth link of the chain of survival concept for out-of-hospital cardiac arrest. Circulation 126:589–597
Bosson N, Kaji AH, Niemann JT et al (2014) Survival and neurologic outcome after out-of-hospital cardiac arrest: results one year after regionalization of post-cardiac arrest care in a large metropolitan area. Prehosp Emerg Care 18:217–223
Wnent J, Seewald S, Heringlake M et al (2012) Choice of hospital after out-of-hospital cardiac arrest–a decision with far-reaching consequences: a study in a large German city. Crit Care 16:R164
Thomas JL, Bosson N, Kaji AH et al (2014) Treatment and outcomes of ST segment elevation myocardial infarction and out-of-hospital cardiac arrest in a regionalized system of care based on presence or absence of initial shockable cardiac arrest rhythm. Am J Cardiol 114:968–971
Vermeer F, Oude Ophuis AJ, vd Berg EJ et al (1999) Prospective randomised comparison between thrombolysis, rescue PTCA, and primary PTCA in patients with extensive myocardial infarction admitted to a hospital without PTCA facilities: a safety and feasibility study. Heart 82:426–431
Widimsky P, Groch L, Zelizko M, Aschermann M, Bednar F, Suryapranata H (2000) Multicentre randomized trial comparing transport to primary angioplasty vs immediate thrombolysis vs combined strategy for patients with acute myocardial infarction presenting to a community hospital without a catheterization laboratory. The PRAGUE study. Eur Heart J 21:823–831
Widimsky P, Budesinsky T, Vorac D et al (2003) Long distance transport for primary angioplasty vs immediate thrombolysis in acute myocardial infarction. Final results of the randomized national multicentre trial–PRAGUE-2. Eur Heart J 24:94–104
Le May MR, So DY, Dionne R et al (2008) A citywide protocol for primary PCI in ST-segment elevation myocardial infarction. N Engl J Med 358:231–240
Abernathy JH 3rd, McGwin G Jr, Acker JE 3rd, Rue LW 3rd (2002) Impact of a voluntary trauma system on mortality, length of stay, and cost at a level I trauma center. Am Surg 68:182–192
Clemmer TP, Orme JF Jr, Thomas FO, Brooks KA (1985) Outcome of critically injured patients treated at Level I trauma centers versus full-service community hospitals. Crit Care Med 13:861–863
Culica D, Aday LA, Rohrer JE (2007) Regionalized trauma care system in Texas: implications for redesigning trauma systems. Med Sci Monit 13:SR9–SR18
Hannan EL, Farrell LS, Cooper A, Henry M, Simon B, Simon R (2005) Physiologic trauma triage criteria in adult trauma patients: are they effective in saving lives by transporting patients to trauma centers? J Am Coll Surg 200:584–592
Harrington DT, Connolly M, Biffl WL, Majercik SD, Cioffi WG (2005) Transfer times to definitive care facilities are too long: a consequence of an immature trauma system. Ann Surg 241:961–966. (discussion 6–8)
Liberman M, Mulder DS, Lavoie A, Sampalis JS (2004) Implementation of a trauma care system: evolution through evaluation. J Trauma 56:1330–1335
MacKenzie EJ, Rivara FP, Jurkovich GJ et al (2006) A national evaluation of the effect of trauma-center care on mortality. N Engl J Med 354:366–378
Mann NC, Cahn RM, Mullins RJ, Brand DM, Jurkovich GJ (2001) Survival among injured geriatric patients during construction of a statewide trauma system. J Trauma 50:1111–1116
Mullins RJ, Veum-Stone J, Hedges JR et al (1996) Influence of a statewide trauma system on location of hospitalization and outcome of injured patients. J Trauma 40:536–545. (discussion 45–46)
Mullins RJ, Mann NC, Hedges JR, Worrall W, Jurkovich GJ (1998) Preferential benefit of implementation of a statewide trauma system in one of two adjacent states. J Trauma 44:609–616. (discussion 17)
Mullins RJ, Veum-Stone J, Helfand M et al (1994) Outcome of hospitalized injured patients after institution of a trauma system in an urban area. JAMA 271:1919–1924
Mullner R, Goldberg J (1978) An evaluation of the Illinois trauma system. Med Care 16:140–151
Mullner R, Goldberg J (1978) Toward an outcome-oriented medical geography: an evaluation of the Illinois trauma/emergency medical services system. Soc Sci Med 12:103–110
Nathens AB, Jurkovich GJ, Rivara FP, Maier RV (2000) Effectiveness of state trauma systems in reducing injury-related mortality: a national evaluation. J Trauma 48:25–30. (discussion -1)
Nathens AB, Maier RV, Brundage SI, Jurkovich GJ, Grossman DC (2003) The effect of interfacility transfer on outcome in an urban trauma system. J Trauma 55:444–449
Nicholl J, Turner J (1997) Effectiveness of a regional trauma system in reducing mortality from major trauma: before and after study. BMJ 315:1349–1354
Potoka DA, Schall LC, Gardner MJ, Stafford PW, Peitzman AB, Ford HR (2000) Impact of pediatric trauma centers on mortality in a statewide system. J Trauma 49:237–245
Sampalis JS, Lavoie A, Boukas S et al (1995) Trauma center designation: initial impact on trauma-related mortality. J Trauma 39:232–237. (discussion 7–9)
Sampalis JS, Denis R, Frechette P, Brown R, Fleiszer D, Mulder D (1997) Direct transport to tertiary trauma centers versus transfer from lower level facilities: impact on mortality and morbidity among patients with major trauma. J Trauma 43:288–295. (discussion 95–96)
Donnino MW, Rittenberger JC, Gaieski D et al (2011) The development and implementation of cardiac arrest centers. Resuscitation 82:974–978
Nichol G, Aufderheide TP, Eigel B et al (2010) Regional systems of care for out-of-hospital cardiac arrest: a policy statement from the American heart association. Circulation 121:709–729
Nichol G, Soar J (2010) Regional cardiac resuscitation systems of care. Curr Opin Crit Care 16:223–230
Soar J, Packham S (2010) Cardiac arrest centres make sense. Resuscitation 81:507–508
Author information
Authors and Affiliations
Corresponding author
Ethics declarations
Interessenkonflikt
J.P. Nolan ist Editor-in-Chief der Resuscitation; A. Cariou ist Ehrensprecher der BARD-France; C.D. Deakin ist Direktor der Prometheus Medical Ltd; H.Friberg ist Ehrensprecher der Bard Medical-Natus Inc; J. Soar ist Editor der Resuscitation B.W. Böttiger, C. Sandroni, K.l Sunde, T. Cronberg und V.R.M. Moulaert geben an, dass kein Interessenkonflikt besteht
Dieser Beitrag beinhaltet keine Studien an Menschen oder Tieren.
Rights and permissions
About this article
Cite this article
Nolan, J., Soar, J., Cariou, A. et al. Postreanimationsbehandlung. Notfall Rettungsmed 18, 904–931 (2015). https://doi.org/10.1007/s10049-015-0094-9
Published:
Issue Date:
DOI: https://doi.org/10.1007/s10049-015-0094-9