Abstract
Purpose
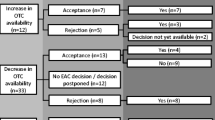
Little is known about the extent of switches from prescription-only (Rx) to over-the-counter (OTC) status in Europe and about the pharmacological properties of the switched substances. The objectives of this study were to provide an overview of the substances that were switched from Rx to OTC status in Germany between 2006 and 2015 and to assess their pharmacological properties.
Methods
Session minutes of the German Expert Advisory Committee for Prescription-Only Issues, changes to the German Ordinance on Prescription-Only Medicines and the Summary of Product Characteristics of the switched substances were analysed. Pharmacological properties were studied in relation to the EU Guideline on Changing the Classification for the Supply of a Medicinal Product for Human Use (the ‘EU switch guide’).
Results
Between 2006 and 2015, seven substances (almotriptan, omeprazole, benzydamine, ibuprofen/pseudoephedrine, racecadotril, ketotifen and levonorgestrel) were switched from Rx to OTC status in Germany. In all cases, the OTC status was restricted to certain indications, doses, pack sizes, or other limitations. Notwithstanding recommendations of the EU switch guide, some of the switched substances might interact with commonly used drugs potentially resulting in serious adverse drug reactions or have contraindications or warnings regarding substantial parts of the population.
Conclusions
The stipulations of the EU switch guide were fully met for only some switches, while this was not completely the case for others. Further development of guidance on balancing risks and benefits of OTC availability is recommended.
Similar content being viewed by others
References
Bundesverband der Arzneimittelhersteller [German Medicines Manufacturers‘ Association] (2015) Der Arzneimittelmarkt in Deutschland: Zahlen und Fakten 2014 [The German pharmaceutical market: Facts and Figures 2014]. https://www.bah-bonn.de/index.php?eID=dumpFile&t=f&f=5526&token=8d393e946b928c6a85c98a1af98e6f2fc0fb5176. Accessed 15.02.2016
Brass EP (2001) Changing the status of drugs from prescription to over-the-counter availability. N Engl J Med 345(11):810–816. doi:10.1056/NEJMra011080
Bond CM, Orru MP, Leder JM, Bouvy M (2004) The over-the-counter pharmaceutical market. In: Mossialos E, Mrazek M, Walley T (eds) Regulating pharmaceuticals in Europe: striving for efficiency, equity and quality. Open University Press, Maidenhead, pp 260–278
Kennedy JG (1994) Over the counter drugs: Changing the roles of doctors and pharmacists. Editorial. BMJ 312:593–594
Francis S-A, Barnett N, Denham M (2005) Switching of prescription drugs to over-the-counter status: is it a good thing for the elderly? Drugs Ageing 22(5):361–370
Shiffman S (2008) Sweeney CT (2008) ten years after the Rx-to-OTC switch of nicotine replacement therapy: what have we learned about the benefits and risks of non-prescription availability? Health Policy 86:17–26. doi:10.1016/j.healthpol.2007.08.006
Millier A, Cohen J, Toumi M (2013) Economic impact of a triptan Rx-to-OTC switch in six EU countries. PLoS One 8(12):e84088. doi:10.1371/journal.pone.0084088
Will CM, Weiner K (2015) The drugs don’t sell: DIY heart health and the over-the-counter statin experience. Soc Sci Med 131:280–288. doi:10.1016/j.socscimed.2014.04.033
Soller RW (1998) Evolution of self-care with over-the-counter medications. Clin Ther 20 Suppl C: C134–140
Juhl RP (1998) Prescription-to-over-the-counter switch: a regulatory perspective. Clinical Therapeutics 20 (Supplement C): C111-C117
Soller RW, Shaheen C (2012) The switch considerations list:“considerations for Rx-to-OTC switch” refined by a critical synthesis of FDA comments on expanded access for naloxone. SelfCare 3(6):121–137
Gotto AM (2006) Over-the-counter statins are worth considering in primary Prevention of cardiovascular disease. Circulation 114:1310–1314. doi:10.1161/CIRCULATIONAHA.105.552257
Shi C-W, Ganiats TG (2005) The debate about over-the-counter emergency contraceptive pills. Journal of Midwifery & Women’s Health 50:423–426
Brune K, Hinz B, Otterness I (2009) Aspirin and acetaminophen: should they be available over the counter? Curr Rheumatol Rep 11(1):36–40
Nguyen NT, Cook DM, Bero LA (2006) The decision-making process of US Food and Drug Administration advisory committees on switches from prescription to over-the-counter status: a comparative case study. Clin Ther 28(8):1231–1243. doi:10.1016/j.clinthera.2006.08.007
Gauld N, Bryant L, Emmerton L, Kelly F, Kurosawa N, Buetow S (2015) Why does increasing public access to medicines differ between countries? Qualitative comparison of nine countries. Journal of health services research & policy 20(4):231–239. doi:10.1177/1355819615593302
Achanta AS, Temkin CW, Rhodes CT (2003) Attitudes and opinions towards regulatory aspects of non-prescription medicines. Clin Res Regul Aff 20(1):1–14
Kroth E (2017) Switch – Wie steht Deutschland im internationalen Vergleich da? Gesundheitsökonomie & Qualitätsmanagement 22(S 01):S3–S11. doi:10.1055/s-0042-120484
Stäbler C (2013) Rx-to-OTC switch and the provision of data exclusivity in Europe - specification and elaboration of eligibility criteria based on a status quo analysis. Doctoral dissertation, Fachbereich Pharmazie, Philipps-Universität Marburg. http://d-nb.info/1044395648/34
European Commission (2006) Guideline on Changing the Classification for the Supply of a Medicinal Product for Human Use. http://ec.europa.eu/health/files/eudralex/vol-2/c/switchguide_160106_en.pdf. Accessed 02.07.2014.
Barrenberg E, Garbe E (2016) Unsuccessful applications to increase or decrease the over-the-counter (OTC) availability of drugs in Germany between 2009 and 2014. J Public Health 1–11. doi:10.1007/s10389-016-0782-z
Bundesinstitut für Arzneimittelsicherheit und Medizinprodukte (2013) Antrag auf Änderung der Verkaufsabgrenzung [application for changes in trade status]. Website. http://www.bfarm.de/DE/Arzneimittel/Pharmakovigilanz/Gremien/Verschreibungspflicht/antragVerkaufsabgrenzung.html. Accessed 12.08.2015
Bundesministerium für Justiz und für Verbraucherschutz (1978) Arzneimittel-Sachverständigenverordnung vom 2. Januar 1978 (BGBl. I S. 30), die zuletzt durch Artikel 1 der Verordnung vom 10. April 2013 (BGBl. I S. 811) geändert worden ist
Reuter K (2009) The Bundesrat and the federal system — The Federal Council of the Federal Republic of Germany. https://www.bundesrat.de/SharedDocs/downloads/DE/publikationen/Bundesrat-und-Bundesstaat-EN.pdf?__blob=publicationFile&v=1. Accessed: 09.03.2017.
Bundesministerium für Justiz und für Verbraucherschutz (1976) Arzneimittelgesetz in der Fassung der Bekanntmachung vom 12. Dezember 2005 (BGBl. I S. 3394), das zuletzt durch Artikel 3 des Gesetzes vom 17. Dezember 2014 (BGBl. I S. 2222) geändert worden ist
Bundesministerium für Justiz und für Verbraucherschutz (2005) Arzneimittelverschreibungsverordnung vom 21. Dezember 2005 (BGBl. I S. 3632), die zuletzt durch Artikel 2 der Verordnung vom 6. März 2015 (BGBl. I S. 278) geändert worden ist
Bundesinstitut für Arzneimittelsicherheit und Medizinprodukte (2009) Ergebnisprotokoll der 63. Sitzung des gemäß § 48 und 53 AMG zu hörenden Sachverständigen-Ausschusses für Verschreibungspflicht am 30. Juni 2009. http://www.bfarm.de/SharedDocs/Downloads/DE/Arzneimittel/Pharmakovigilanz/Gremien/Verschreibungspflicht/63Sitzung/protokoll.pdf?__blob=publicationFile&v=2. Accessed 28.01.2015
BfArM (2010) Ergebnisprotokoll der 65. Sitzung des gemäß § 48 und 53 AMG zu hörenden Sachverständigen-Ausschusses für Verschreibungspflicht am 06.07.2010. Bundesinstitut für. Arzneimittelsicherheit und Medizinprodukte, Bonn. http://www.bfarm.de/DE/Arzneimittel/Pharmakovigilanz/Gremien/Verschreibungspflicht/Protokoll/65Sitzung/protokoll_65.html. Accessed 28.01.2015.
Schwabe U, Paffrath D (2015) Arzneiverordnungs-Report 2015. Springer, Berlin Heidelberg
Telschow C (2015) TOP 100 prescribed and dispensed substances in DDD in 2014 In: GKV-Arzneimittelindex im Wissenschaftlichen Institut der AOK (WIdO) ─ Fertigarzneimittel. WIdO
European Commission (2005) A Guideline on Summary of Product Characteristics. http://ec.europa.eu/health/files/eudralex/vol-2/c/spcguidrev1-oct2005_en.pdf. 04.12.2016. Accessed 04.12.2016
International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (2003) ICH Harmonised Tripartite Guideline: Post-Approval Safety Data Management: Definitions and Standards for Expedited Reporting E2D. http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Efficacy/E2D/Step4/E2D_Guideline.pdf. Accessed 02.03.2016.
Gauld NJ, Kelly FS, Kurosawa N, Bryant LJ, Emmerton LM, Buetow SA (2014) Widening consumer access to medicines through switching medicines to non-prescription: a six country comparison. PLoS One 9(9):e107726. doi:10.1371/journal.pone.0107726
Wessels NF (2006) Analyse des Ausmasses des OTC-Arzneimittelkonsums in den Jahren 1990 bis 2000 unter Berücksichtigung arzneimittelrelevanter Aspekte – Eine Untersuchung zum Informationsgehalt in Werbeanzeigen und Werbespots [Analysis of of OTC drug consumption between 1990 and 2000 – a study on advertisements]. Doctoral dissertation, Fachbereich 11, Universität Bremen. http://elib.suub.uni-bremen.de/diss/docs/00010589.pdf
Helmstaedter G (1985) Die Verschreibungspflicht aus Sicht der Arzneimittelhersteller. In: Beske F, Cranz H, Eberwein B, Kranz HA (eds) Die Funktion der Rezeptpflicht im heutigen Gesundheitswesen. Schmidt & Klauning, Kiel, pp 25–32
Soller RW, Chan PV, Shaheen C (2011) OTC considerations for expanding access to nonprescription medicines: a critical synthesis of questions from the Food and Drug Administration to its advisory committees on Rx-to-OTC switch. SelfCare 2(5):117–138
Mahecha LA (2006) Rx-to-OTC switches: trends and factors underlying success. Nat Rev Drug Discov 5(5):380–385. doi:10.1038/nrd2028
BfArM (2009) Ergebnisprotokoll der 62. Sitzung des gemäß § 48 und 53 AMG zu hörenden Sachverständigen-Ausschusses für Verschreibungspflicht am 13. Januar 2009. Bundesinstitut für Arzneimittelsicherheit und Medizinprodukte, Bonn. http://www.bfarm.de/SharedDocs/Downloads/DE/Arzneimittel/Pharmakovigilanz/Gremien/Verschreibungspflicht/62Sitzung/protokoll.pdf?__blob=publicationFile&v=2. Accessed 20.07.2015
Schersch S, Tebroke E (2015) Pille danach: Bundesrat stimmt Freigabe zu. Pharmazeutische Zeitung Online 11/2015, http://www.pharmazeutische-zeitung.de/index.php?id=56881. Accessed 09.03.2017
Bundesinstitut für Arzneimittelsicherheit und Medizinprodukte (2014) Ergebnisprotokoll 71. Sitzung des Sachverständigenausschusses für Verschreibungspflicht nach § 53 Abs. 2 AMG vom 14.01.2014. http://www.bfarm.de/DE/Arzneimittel/Pharmakovigilanz/Gremien/Verschreibungspflicht/Protokolle/71Sitzung/protokoll_71.html. Accessed 06.07.2014
Michel M (2012) Antrag auf Aufhebung der Verschreibungspflicht für Racecadotril 100 mg Kapseln gemäß § 48 und § 53 AMG: Sitzung des Sachverständigenausschusses für Verschreibungspflicht am 27. Februar 2012. http://www.bfarm.de/SharedDocs/Downloads/DE/Arzneimittel/Pharmakovigilanz/Gremien/Verschreibungspflicht/68Sitzung/anlage6.pdf;jsessionid=F00C37D5089492E2B814E1541D980D66.1_cid350?__blob=publicationFile&v=3. Accessed 07.07.2014.
Bundesinstitut für Arzneimittelsicherheit und Medizinprodukte (2011) Ergebnisprotokoll 66. Sitzung des gemäß §§ 48 und 53 AMG zu hörenden Sachverständigen-Ausschusses für Verschreibungspflicht vom 11.01.2011. http://www.bfarm.de/DE/Arzneimittel/Pharmakovigilanz/Gremien/Verschreibungspflicht/Protokolle/66Sitzung/protokoll_66.html. Accessed: 28.01.2015
Bundesinstitut für Arzneimittelsicherheit und Medizinprodukte (2011) Ergebnisprotokoll Außerordentliche Sitzung zu Analgetika des gemäß §§ 48 und 53 AMG zu hörenden Sachverständigen-Ausschusses für Verschreibungspflicht vom 27.09.2011. http://www.bfarm.de/DE/Arzneimittel/Pharmakovigilanz/Gremien/Verschreibungspflicht/Protokolle/ausseroSitzung_110927/protokoll.html. Accessed: 10.07.2014
Bundesinstitut für Arzneimittelsicherheit und Medizinprodukte (2012) Ergebnisprotokoll 68. Sitzung des gemäß §§ 48 und 53 AMG zu hörenden Sachverständigen-Ausschusses für Verschreibungspflicht vom 27.02.2012. http://www.bfarm.de/DE/Arzneimittel/Pharmakovigilanz/Gremien/Verschreibungspflicht/Protokolle/68Sitzung/protokoll_68.html. Accessed 07.07.2014
Hughes B, Durran A, Langford NJ, Mutimer D (2003) Paracetamol poisoning – impact of pack size restrictions. J Clin Pharm Ther 28(4):307–310
Morgan O, Griffiths C, Majeed A (2005) Impact of paracetamol pack size restrictions on poisoning from paracetamol in England and Wales: an observational study. J Public Health (Oxf) 27(1):19–24. doi:10.1093/pubmed/fdh216
Morgan O, Hawkins L, Edwards N, Dargan P (2007) Paracetamol (acetaminophen) pack size restrictions and poisoning severity: time trends in enquiries to a UK poisons centre. J Clin Pharm Ther 32(5):449–455. doi:10.1111/j.1365-2710.2007.00842.x
Greene SL, Dargan PI, Leman P, Jones AL (2006) Paracetamol availability and recent changes in paracetamol poisoning: is the 1998 legislation limiting availability of paracetamol being followed? Postgrad Med J 82(970):520–523
Sarchiapone M, Mandelli L, Iosue M, Andrisano C, Roy A (2011) Controlling access to suicide means. Int J Environ Res Public Health 8(12):4550–4562. doi:10.3390/ijerph8124550
Gößwald A, Schienkiewitz A, Nowossadeck E, Busch MA (2013) Prevalence of myocardial infarction and coronary heart disease in adults aged 40–79 years in Germany. Bundesgesundheitsbl Gesundheitsforsch Gesundheitsschutz 56(5):650–655. doi:10.1007/s00103-013-1666-9
Neuhauser HK, Adler C, Rosario AS, Diederichs C, Ellert U (2015) Hypertension prevalence, awareness, treatment and control in Germany 1998 and 2008-11. J Hum Hypertens 29(4):247–253. doi:10.1038/jhh.2014.82
Scheidt Nave C, Du Y, Knopf H, Schienkiewitz A, Ziese T, Nowossadeck E, Gößwald A, Busch MA (2013) Prevalence of dyslipidemia among adults in Germany. Bundesgesundheitsbl Gesundheitsforsch Gesundheitsschutz 56(5–6):661–667
Mensink GBM, Schienkiewitz A, Scheidt-Nave C (2012) Overweight and obesity in Germany: are we getting fatter? Bundesgesundheitsbl Gesundheitsforsch Gesundheitsschutz 2012(55):983
Robert Koch Institut (2014) Diabetes mellitus. Faktenblatt zu GEDA 2012: Ergebnisse der Studie »Gesundheit in Deutschland aktuell 2012«. https://www.rki.de/DE/Content/Gesundheitsmonitoring/Gesundheitsberichterstattung/GBEDownloadsF/Geda2012/Diabetes_mellitus.pdf?__blob=publicationFile. Accessed: 01.03.2016
Robert Koch Institut (2014) Rauchen. Faktenblatt zu GEDA 2012: Ergebnisse der Studie »Gesundheit in Deutschland aktuell 2012«. https://www.rki.de/DE/Content/Gesundheitsmonitoring/Gesundheitsberichterstattung/GBEDownloadsF/Geda2012/rauchen.pdf?__blob=publicationFile. Accessed: 01.03.2016
Bundesinstitut für Arzneimittelsicherheit und Medizinprodukte (2007) Ergebnisprotokoll 59. Sitzung des gemäß §§ 48 und 53 AMG zu hörenden Sachverständigen-Ausschusses für Verschreibungspflicht vom 03.07.2007. http://www.bfarm.de/SharedDocs/Downloads/DE/Arzneimittel/Pharmakovigilanz/Gremien/Verschreibungspflicht/59Sitzung/protokoll.pdf?__blob=publicationFile&v=2. Accessed 24.09.2015
Anonymous External Expert (2012) Entlassung aus der Verschreibungspflicht für die fixe Kombination zur oralen Anwendung aus Ibuprofen/Pseudoephedrin in der maximalen Tagesdosierung 1200 mg Ibuprofen und 180 mg Pseudoephedrin gemäß § 48 und § 53 AMG. http://www.bfarm.de/SharedDocs/Downloads/DE/Arzneimittel/Pharmakovigilanz/Gremien/Verschreibungspflicht/69Sitzung/anlage9.pdf?__blob=publicationFile&v=3. Accessed 07.07.2014
Gessner U, Petersen-Braun M (2005) AWB Aspirin Complex: Bewährt gegen Halsweh, Schnupfen und erkältungsbedingte Schmerzen. Pharmazeutische Zeitung Online 38/2005, http://www.pharmazeutische-zeitung.de/index.php?id=pharm4_38_2005. Accessed 10.03.2017
FDA (2013) Guidance for industry: self-selection studies for nonprescription drug products. U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER). http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM272122.pdf. Accessed 06.11.2015
Boehringer Ingelheim International (2015) Fachinformation: BoxaGrippal® 200 mg / 30 mg Filmtabletten. http://www.fachinfo.de/suche/fi/014667. Accessed 08.10.2015
Freytag A, Quinzler R, Freitag M, Bickel H, Fuchs A, Hansen H, Hoefels S, Konig HH, Mergenthal K, Riedel-Heller SG, Schon G, Weyerer S, Wegscheider K, Scherer M, van den Bussche H, Haefeli WE, Gensichen J (2014) Gebrauch und potenzielle Risiken durch nicht verschreibungspflichtige Schmerzmittel [Use and potential risks of over-the-counter analgesics]. Schmerz 28(2):175–182. doi:10.1007/s00482-014-1415-5
Friese H-G (1985) Die Verschreibungspflicht von Arzneimitteln aus der Sicht des Apothekers. In: Beske F, Cranz H, Eberwein B, Kranz HA (eds) Die Funktion der Rezeptpflicht im heutigen Gesundheitswesen. Schmidt & Klauning, Kiel, pp 17–20
Bundesinstitut für Arzneimittelsicherheit und Medizinprodukte (2007) Voten des Sachverständigen-Ausschusses für Verschreibungspflicht nach § 53 AMG 59. Sitzung, 03.07.2007 zu Positionen, deren Änderung abgestimmt wurde. http://www.bfarm.de/SharedDocs/Downloads/DE/Arzneimittel/Pharmakovigilanz/Gremien/Verschreibungspflicht/59Sitzung/anlage1.pdf?__blob=publicationFile&v=3. Accessed 27.11.2015
Schmiedl S, Rottenkolber M, Hasford J, Rottenkolber D, Farker K, Drewelow B, Hippius M, Salje K, Thurmann P (2014) Self-medication with over-the-counter and prescribed drugs causing adverse-drug-reaction-related hospital admissions: results of a prospective, long-term multi-centre study. Drug Saf 37(4):225–235. doi:10.1007/s40264-014-0141-3
Acknowledgements
The authors wish to thank the ‘Wissenschaftliches Institut der AOK (WIdO)’ for providing information on the top 100 prescribed pharmaceutical substances dispensed at the cost of German statutory health insurance. The authors also wish to thank Dr. Heike Gerds for editing the manuscript.
Author information
Authors and Affiliations
Corresponding author
Ethics declarations
Conflict of interest
The study did not receive any external funding. EB has no conflict of interest. EG serves as deputy member of the Expert Advisory Committee for Prescription-Only Issues and was present during two of the analysed sessions. She formerly ran a department that occasionally performs studies for pharmaceutical industries. These companies include Bayer, Celgene, GSK, Mundipharma, Novartis, Sanofi, Sanofi Pasteur MSD, and STADA. EG has been a consultant to Bayer, Nycomed, Teva, GSK, Schwabe, Novartis, Takeda and AstraZeneca.
Contributions of author’s statement
EB and EG jointly developed the research idea and conceptualized the study. EB conducted the data analysis and prepared the manuscript, EG provided substantive intellectual input and critically reviewed the manuscript.
Rights and permissions
About this article
Cite this article
Barrenberg, E., Garbe, E. From prescription-only (Rx) to over-the-counter (OTC) status in Germany 2006–2015: pharmacological perspectives on regulatory decisions. Eur J Clin Pharmacol 73, 901–910 (2017). https://doi.org/10.1007/s00228-017-2240-4
Received:
Accepted:
Published:
Issue Date:
DOI: https://doi.org/10.1007/s00228-017-2240-4