Abstract
The 2007 health care reform has introduced maximum prices for prescription drugs in German social health insurance. In contrast to internal reference pricing — which has been introduced in 1989 — maximum prices need to be based on an assessment performed by the IQWiG of the patient relevant costs and benefits of all therapeutic alternatives to the respective drugs. Alternatively, they can be negotiated between the peak organisation of social health insurers and individual manufacturers. Moreover, costs for research and development need to be taken into account. e aim to assess the feasibility of maximum prices in the context of German social health insurance.
Methods
We compare direct price regulation in France and Switzerland and indirect price regulation in England and Wales to German regulation. Moreover, we compare the relationship between the determination of prices to the clinical and economic effectiveness of prescription drugs in these countries.
Results
In both France and Switzerland the determination of prices of prescription drugs is connected to the listing on national formularies. Thus, manufacturers face strong incentives to acknowledge prices which are limited by price regulation. In both countries, higher incremental clinical effectiveness leads to price mark-ups. Costs for research and development are taken into account in a rather arbitrary fashion. Economic evaluation is hardly relevant for the determination of prices.
Discussion
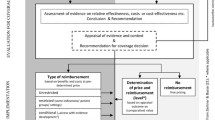
In contrast to France and Switzerland, manufacturers in Germany face little incentives to acknowledge maximum prices for their products. First, maximum prices may only be determined by the peak organisation of social health insurers if sufficient data on costs and benefits are available. However, in Germany the scientific infrastructure for the application of pharmacoeconomic assessments still needs substantial development in order to provide economic evaluations on a regular basis. If, secondly, the threat of unilateral determination of maximum prices is a weak one and maximum prices are not linked to a national formulary, manufacturers will continue to determine prices themselves. Since Germany is an important reference country for external reference pricing, we conclude that the current maximum price regulation in Germany will have little impact.
Similar content being viewed by others
Literatur
Bundesgesetz über die Krankenversicherung (KVG), SR832.10 vom 18. März 1994 (Stand am 1. August 2008). Erhältlich unter: http://www.admin.ch/ch/d/sr/8/832.10.de.pdf [Abgerufen 28.11.2008]
Pharma-Markt Schweiz. Ausgabe 2007. 14. Auflage herausgegeben 2007 von Interpharma. Verband der forschenden pharmazeutischen Firmen der Schweiz; Basel, Schweiz, 2007. Erhältlich unter: http://www.interpharma.ch/de/pdf/Pharma_Markt_Schweiz_07d.pdf [Abgerufen 26.02.2008]
Verordnung über die Krankenversicherung (KVV), SR832.102 vom 27. Juni 1995 (Stand am 1. Januar 2008). Erhältlich unter: http://www.admin.ch/ch/d/sr/8/832.102.de.pdf [Abgerufen 03.01.2008]
Handbuch betreffend die Spezialitätenliste (SL). Gültig ab 1. Februar 2008. Bern, Schweiz: BAG, 2008: 1–28
Zentner A, Velasco-Garrido M, Busse R. Methoden zur vergleichenden Bewertung pharmazeutischer Produkte. Eine internationale Bestandsaufnahme zur Arzneimittelevaluation. Schriftenreihe Health Technology Assessment, Bd. 13. Herausgegeben vom Deutschen Institut für Medizinische Dokumentation und Information (DIMDI). Berlin: 1. Auflage 2005
Paris V, Docteur E. Pharmaceutical pricing and reimbursement policies in Switzerland. Paris: OECD Health Working Papers, 2007
Niebuhr D, Rothgang H, Wasem J, et al. Die Bestimmung des Leistungskataloges in der gesetzlichen Krankenversicherung. Band 2: Verfahren und Kriterien zur Bestimmung des Leistungskatalogs in der gesetzlichen Krankenversicherung vor dem Hintergrund internationaler Erfahrungen. Düsseldorf: edition der Hans-Böckler-Stiftung 2004; Nr. 108
NZZ Online. Die Preise von 1000 Medikamenten sinken. Einsparungen von bis zu 150 Millionen Franken pro Jahr zu erwarten. Neue Zürcher Zeitung (NZZ). 26. September 2007. Erhältlich unter: http://www.nzz.ch/nachrichten/schweiz/aktuell/die_preise_von_1000_medikamenten_sinken_1.560784.html [Abgerufen 03.01.2008]
Haute Autorité de Santé. Commission de la Transparence. Règlement intérieur. 22 juin 2005 modifié les 20 juillet et 19 octobre 2005 et les 18 janvier, 29 mars, 10 mai, 19 juillet et 4 octobre 2006 et le 2 juillet 2008 [in Französisch]. Erhältlich unter: http://www.has-sante.fr/portail/upload/docs/application/pdf/ri_ct_2005_v.04-10-06.pdf [Abgerufen 10.04.2008]
Rapport d’activité de la Commission de la Transparence 2004. 10 Octobre 2005 [in Französisch]. Erhältlich unter: http://www.has-sante.fr/portail/upload/docs/application/pdf/ri_ct_2005_v.04-10-06.pdf [Abgerufen 10.04.2008]
ÖBIG. Surveying, assessing and analysing the pharmaceutical sector in the 25 EU member states. Commissioned by European Commission — DG Competition. Wien: Österreichisches Bundesinstitut für Gesundheitswesen, 2006
Häussler B, Albrecht M, Cassel D, et al. Steuerung der Arzneimittelausgaben und Stärkung des Forschungsstandortes für die pharmazeutische Industrie. Gutachten für das Bundesministerium für Gesundheit. Berlin: Institut für Gesundheits- und Sozialforschung GmbH (IGES); Juni 2006: 1–455
Comité Economique des Produits de Santé. Accord cadre entre le comité économique des produits de santé et les entreprises du médicament pour la période 2003–2006. o. J. [in Französisch]. Erhältlich unter: http://www.sante.gouv.fr/ceps/hregul2.htm [Abgerufen 10.04.2008]
Garattini L, Cornago D, De Compadri P. Pricing and reimbursement of in-patent drugs in seven European countries: Acomparative analysis. Health Policy 2007; 82(3): 330–339
NICE. Guide to the methods of technology appraisal. London: National Institute for Clinical Excellence, NHS, April 2004
House of Commons — Health Committee. National Institute for Clinical Excellence — Second Report of Session 2001–02, HC 515-1, London: The Stationery Office, June 2002
Rothgang H, Niebuhr D, Wasem J, et al. Das National Institute for Clinical Excellence (NICE). Staatsmedizinisches Rationierungsinstrument oder Vorbild für die evidenzbasierte Bewertung medizinischer Leistungen? Das Gesundheitswesen 2004; 66(5): 303–10
NICE. A guide for manufacturers and sponsors. Contributing to a technology appraisal. London: National Institute for Clinical Excellence, N0518, 2004
Understanding the 2005 PPRS. Industry briefing. The Association of the British Pharmaceutical Industry (abpi). London, 2005
The pharmaceutical price regulation scheme 2005. London: Department of Health, Nov 2004. Erhältlich unter: http://www.dh.gov.uk/en/Publicationsandstatistics/Publications/PublicationsPolicyAndGuidance/DH_4093228 [Abgerufen 27.02.2008]
The pharmaceutical price regulation scheme. An OFT market study. Office of Fair Trading, Feb 2007. Erhältlich unter: http://www.oft.gov.uk/shared_oft/reports/comp_policy/oft885.pdf [Abgerufen 13.05.2008]
Towse A. If it ain’t broke, don’t price fix it: the OFT and the PPRS. Health Economics 2007; 16(7): 653–665
Thornton S. Drug price reform in the UK: debunking the myths. Health Economics 2007; 16(10): 981–992
Methodik für die Bewertung von Verhältnissen zwischen Nutzen und Kosten im System der deutschen gesetzlichen Krankenversicherung. Version 1.1 vom 09.10.2008. Köln: Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG), 2008
3 Jahre IQWiG: Produktiver Start im Gegenwind. Pressemitteilung vom 08.11.2007. Erhältlich unter: http://www.iqwig.de/index.702.html [Abgerufen 10.12.2007]
von der Schulenburg J-MG, Greiner W, Jost F, et al. Deutsche Empfehlungen zur gesundheitsökonomischen Evaluation — dritte und aktualisierte Fassung des Hannoveraner Konsens. Gesundheitsökonomie und Qualitätsmanagement 2007; 12: 285–290
Krauth C, John J, Aidelsburger P, et al. Stellungnahme der AG Methoden der gesundheitsökonomischen Evaluation (AG MEG) zu dem Methodenpapier „Methodik für die Bewertung von Verhältnissen zwischen Nutzen und Kosten im System der deutschen gesetzlichen Krankenversicherung“ des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG). Das Gesundheitswesen 2008; 70(6): e1–e16
Stargardt T, Schreyögg J. Impact of cross-reference pricing on pharmaceutical prices: manufacturers’ pricing strategies and price regulation. Applied Health Economics & Health Policy 2006; 5(4): 235–247
Bericht der Bundesregierung über die Erfahrungen der Spitzenverbände der Krankenkassen bei der Festsetzung der Erstattungshöchstbeträge und die Auswirkungen auf die pharmazeutischen Unternehmen. Bundesrat-Drucksache 723/08 vom 8.10.2008
Author information
Authors and Affiliations
Corresponding author
Rights and permissions
About this article
Cite this article
Niebuhr, D., Hessel, F. & Greß, S. Preisregulierung und Kosten-Nutzen-Bewertung von Arzneimitteln im Ländervergleich — Internationale Erfahrungen und Optionen für Deutschland. Pharmacoeconomics-Ger-Res-Articles 6, 79–99 (2008). https://doi.org/10.1007/BF03320752
Published:
Issue Date:
DOI: https://doi.org/10.1007/BF03320752