Abstract
A plaque that has a large lipid core and a thin fibrous cap may undergo rupture. Once it ruptures, it may lead to thrombus formation and subsequent vessel occlusion. To identify unstable plaques before they rupture is essential for clinical management and patient’s prognosis. Intravascular ultrasound (IVUS) opens a new window for the assessment of plaque morphology to identify vulnerable plaques and plaque rupture.
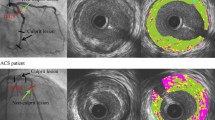
We examined 144 patients with angina and ischemic ECG changes using IVUS. Ruptured plaques, characterized by a plaque cavity and a tear on the thin fibrous cap, were identified in 31 patients (group A) of which 23/31 (74%) clinically presented as unstable angina. Plaque rupture was confirmed by injecting contrast medium filling the plaque cavity during IVUS examination. Of the patients without plaque rupture (group B, n=108), only 19 (18%) had unstable angina. No significant differences between the 2 groups were found concerning the vessel and plaque areas (p>0.05). The percent stenosis in group A (56.2±16.5%) was significantly lower than in group B (67.9±13.4%) (p<0.001). Area of the plaque cavity in group A (4.1±3.2 mm2) was significantly larger than the echolucent zone in group B (1.32±0.79 mm2) (p<0.001). The plaque cavity/plaque ratio in group A (38.5±17.1%) was larger than the echolucent area/plaque ratio in group B (11.2 ±8.9%) (p<0.001). The thickness of the fibrous cap in group A (0.47±0.20 mm) was significantly thinner than that (0.96±0.94 mm) in group B (p<0.001).
Conclusions: Plaques seem to be prone to rupture when the echolucent area is larger than 1 mm2, the echolucent area/plaque ratio greater than 20% and the fibrous cap thinner than 0.7 mm. IVUS has the capacity of identifying plaque rupture and vulnerable plaques. This may have potential influence on patients management and therapy.
Zusammenfassung
Die Entwicklung der Arteriosklerose wird in sechs Stadien eingeteilt. Kennzeichnend ist die Zunahme der Lipideinlagerung, die immer größere Areale der gesamten Plaquefläche einnimmt. Während das Stadium I nur mikroskopisch sichtbar ist, kommen im Stadium II bereits mit bloßem Auge subintimal Fetteinlagerungen zur Darstellung (fatty streakes). Das Stadium III bildet ein intermediäres Stadium, das häufig in ein progressives Stadium der Atherombildung (Stadium IV) und Fibroatherombildung übergeht (Va). Der Übergang vom Stadium IV zum Stadium V ist durch die Einlagerung von Kollagen gekennzeichnet. Dominiert die Kalkeinlagerung, wird vom Stadium Vb gesprochen und bei Dominanz fibrotischer Anteile vom Stadium Vc. Die Lipideinschlüsse liegen zunächst in der Adventitia-nahen Zone der Plaque. Die Größenzunahme führt zu einer Abnahme der fibrösen Kappe, die den Lipidkern zum Lumen hin abgrenzt. Je dünner die Platte, je weniger glatte Muskelzellen und je mehr Schaumzellen vorhanden sind, um so unstabiler wird diese Plaqueform (Va).
Plaquerupturen können als oberflächliche Rißbildungen oder tiefe Einrisse sowohl im Zentrum als auch im Randgebiet der fibrösen Platte auftreten. In der Folge kann eine Auswaschung des Atheroms stattfinden (Stadium VIa) oder eine Thrombosierung komplett oder inkomplett das Lumens umschließen (Stadium VIc). Einblutungen, die in eine Plaque erfolgen, werden als Stadium VIb bezeichnet.
Mittels intravaskulärem Ultraschall ist eine Darstellung des Lumens und der Gefäßwand der Koronararterien mit einer Auflösung von 150 μm möglich. Selbst eine Gewebedifferenzierung gelingt, da verkalkte Plaques an einer Schallschattenbildung erkannt werden und lipidreiche Plaques durch eine verminderte Echogenität auffallen. Selbst Thromben können differenziert werden, wenn sie als Charakteristika eine unregelmäßige Lumenbegrenzung, frei flottierende Strukturen, Schichtbildungen und Katheterabdrücke aufweisen. Plaquerupturen können als Unterbrechung der fibrösen Platte mit Plaqueulzeration (Stadium VIa) sicher erfaßt werden. Selbst intramurale Hämatombildung (VIb) ist nachgewiesen worden.
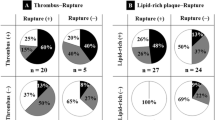
Vergleichende Untersuchungen bei stabilen und unstabilen Patienten haben die Schichtbildung mit Thrombusbildung als typisches Charakteristikum einer akuten Koronarsymptomatik nachgewiesen. In einer Gruppe von 139 Patienten wurden bei 22% der Patienten eine Plaqueruptur mit Ulzerationen und bei 78% stabile Plaques ohne Ruptur festgestellt. Bei nachgewiesener Plaqueruptur lag die Rupturstelle, wie von histomorphologischer Seite beschrieben, in 50% der Fälle am Übergang der fibrösen Kappe zum Plaqueareal und in ca. 30% der Fälle zentral. Pathologisch-anatomisch wurden häufiger oberflächliche Plaqueeinrisse dargestellt, die im intravaskulären Ultraschall nur gelegentlich zur Darstellung kamen, da die Auflösung noch nicht ausreichte. Eine wichtige Erkenntnis war, daß 74% der Patienten mit Zeichen der Plaqueruptur eine unstabile Angina pectoris aufwiesen, aber 26% auch eine stabile Angina. Umgekehrt hatten 18% der Patienten mit unstabiler Angina keine Plaqueruptur. Dies bedeutet, daß auch bei stabiler Angina pectoris Plaquerupturen ins 20 bis 30% der Fälle auftreten können. Die fibröse Kappe war entsprechend pathologisch-anatomischen Befunden bei aufgetretener Plaqueruptur dünner als bei nicht rupturierten Plaques und die Ulzerationsfläche größer als der Lipidkern. Zwischenzeitliche konnten selbst Abheilungen von Plaquerupturen vergolt werden. Sie sind gekennzeichnet durch ein Anlegen der rupturierten Intimamembran an die Gefäßwand, so daß eine Schichtbildung mit zunehmender Dicke der Plaque auftritt.
Zusammenfassung: Plaquarupturen treten bei stabiler und unstabiler Angina pectoris auf. Sowohl Thrombosierungen als auch Plaqueulzerationen und intramurale Hämatombildungen werden als Ausdruck akuter Koronarysndrome nachgewiesen. Der intravaskuläre Ultraschall eröffnet ein neues Fenster zum Verständnis der Pathogenese der Koronarsklerose.
Similar content being viewed by others
References
Ambrose JA, Winters SL, Stern A, et al. Angiographic morphology and the pathogenesis of unstable angina pectoris. J Am Coll Cardiol 1985;5:609–16.
Annex B, Denning S, Channon K, et al. Differential expression of tissue factor protein in directional atherectomy specimens from patients with stable adn unstable coronary syndromes. Circulation 1995;91:619–22.
Barger AC, Beeuwkes R, Lainey LL, et al. Hypothesis: Vasa vasorum and neovascularization of human coronary arteries: a possible role in the pathophysiology of atherosclerosis. N Engl J Med 1991;88:8154–8.
Baumgart D, Liu F, Haude M, et al. Acute plaque rupture and myocardial stunning in patient with normal coronary arteriography. Lancet 1995;346:193–4.
Benson RL. The present status of coronary arterial disease. Arch Pathol 1992;2:870–916.
Binns RL, Ku DN. Effect of stenosis on wall motion: a possible mechanism of stroke and transient ischemic attack. Arteriiosclerosis 1989;9:842–7.
Clark E, Graef I, Chasis H. Thrombosis of aorta and coronary arteries, with special reference to “fibrinoid” lesions. Arch Pathol 1936;22:183–212.
Davies M, Richardson P, Woolf N, et al. Risk of thrombosis in human atherosclerotic plaques: role of extracellular lipid, macrophage, and smooth muscle cell content. Br Heart J 1993;69:377–81.
Davies MJ, Bland MJ, Hangartner WR, et al. Factors influencing the presence of absence of acute coronary thrombi in sudden ischemic death. Eur Heart J 1989;10:203–8.
Davies MJ, Thomas AC. Plaque fissuring — the cause of acute myocardial infarction, sudden ischemic death, and crescendo angina. Br Heart J 1985:363–73.
Davies MJ, A macro and micro view of coronary vqscular insult in ischemic heart disease. Circulation 1990;82:Suppl I:1138–46.
Di Mario C, The SHK, Madretsma S, et al. Detection and characterization of vascular lesions by intravascular ultrasound: an in vitro study correlated with histology. J Am Soc Echocardiogr 1992;5:135–46.
Erbel R, Ge J, Görge G, et al. Intravaskuläre Sonographie bei koronarer Herzkrankheit, Neue Aspekte zur Pathogenese. Dtsch Med Wochenschr 1995;120:847–54.
Erbel R, Ge J, Görge G, et al. Analysis of pathogenesis of atherosclerosis by intravascular ultrasound. In: Beyar R, Keren G, Leon MB, Serruys PW, eds. Frontiers in interventional cardiology. London: Martin Dunitz, 1997:231–41.
Falk E. Morphoiogical features of unstable atherosclerotic plaques underlying acute coronary syndromes. Am J Cardiol 1989;63:114E-20E.
Falk E. Plaque rupture with severe pre-existing stenosis precipitating coronary thrombosis: characteristics of coronary atherosclerotic plaques underlying fatal occlusive thrombi. Br Heart J 1983;50:127–34.
Falk E. Unstable angina with fatal outcome: dynamic coronary thrombosis leading to infarction and/or sudden death: autopsy evidence of recurrent mural thrombosis with peripheral embolization culminating in total vascular occlusion. Circulation 1985;71:699–708.
Falk E, Why do plaques rupture? Circulation 1992;86:Suppl:30–42.
Farb A, Burke AP, Tang AL, et al. Coronary plaque erosion without rupture into a lipid core: a frequent cause of coronary thrombosis in sudden coronary death. Circulation 1996;93:1354–63.
Fernandez OA, Badimon JJ, Falk E, et al. Characterization of the relative thrombogenicity of atherosclerotic plaque components: implications for consequences of plaque rupture. J Am Coll Cardiol 1994;23:1562–9.
Fitzgerald PJ, Connolly AJ, Watkins RD, et al. Distinction between soft anf thrombus by intravascular ultrasound tissue characterization. J Am Coll Cardiol 1991;17:111A. abstract.
Fitzgerald PJ, Ports TA, Yock PY. Contribution of localized calcium deposits to dissection after angioplasty, an observational study using intravascular ultrasound. Circulation 1992;86: 64–70.
Fuster V, Badimon L, Badimon JJ, et al. The pathogenesis of coronary disease and the acute coronary syndromes. N Engl J Med 1992;326:242–318.
Fuster V, Stein B, Ambrose JA, et al. Atherosclerotic plaque rupture and thrombosis: evolving concepts. Circulation 1990;82:Suppl II:47–59.
Ge J, Erbel R, Gerber T, et al. Intravascular ultrasound imaging of angiographically normal coronary arteries: a prospective study in vivo. Br Heart J 1994;71:572–8.
Ge J, Erbel R, Zamorano J, et al. Coronary artery remodeling in atherosclerotic disease: an intravascular ultrasound study in vivo. Coron Artery Dis 1993;4:981–6.
Ge J, Haude M, Görge G, et al. Silent healing of spontaneous plaque rupture demonstrated by intracoronary ultrasound. Eur Heart J 1995;16:1149–51.
Ge J, Liu F, Görge G, et al. Visualization of ulcerated unstable plaques by intracoronary ultrasound. Z Kardiol 1995;84:1–86.
Ge J, Liu F, Kearney P, et al. Acute coronary artery closure following intracoronary ultrasound examination. Cath Cardiovasc Diagn 1995;35:232–5.
Ge J, Erbel R. Intravascular ultrasound imaging of ruptured plaques. In: Erbel R, Roelandt JRTC, Görge G, eds. Intravascular ultrasound. London: Martin Dunitz 1998: 105–13.
Ge J, Chirillo F, Schwedtmann J, et al. Screening of ruptured plaques in patients with coronary artery disease by intravascular ultrasound. Heart 1999 (in press).
Gertz SD, Roberts WC. Hemodynamic shear stress force in rupture of coronary arterial atherosclerotic plaques. Am J Cardiol 1990;66:1368–72.
Hausmann D, Erbel R, Alibelli-Chemarin MJ, et al. The safety of intracoronary ultrasound: a multicenter surgery of 2207 examinations. Circulation 1995;91:623–30.
Hiro T, Leung CY, de Guzman S, et al. Are “soft echos” really soft? Ultrasound assessment of mechanical properties in human atherosclerotic tissue. Circulation 1995;92:Suppl I:1–649.abstract.
Honye J, Mahon DJ, Jain A, et al. Morphological effects of coronary balloon angioplasty in vivo assessed by intravascular ultrasound imaging. Circulation 1992;85:1012–25.
Hort W. Der arteriosklerotische Polsterriß. Versicherungsmedizin 1991;43:151–4.
Jorgensen L, Rowsell HC, Hovig T, et al. Adenosine diphosphate-induced platelet aggregation and myocardial infarction in swine. Lab Invest 1967;17:616–44.
Kearney P, Erbel R, Rupprecht HJ, et al. Differences in the morphology of unstable and stable coronary lesions and their impact on the mechanisms of angioplasty. An in vivo study with intravascular ultrasound. Eur Heart J 1996;17:721–30.
Koch W, Kong LC, Über die Formen des Coronarverschlusses. Die Änderung im Coronarkreislauf und die Beziehung zur Angina pectoris. Beitr Pathol Anat 1932;90:21–84.
Leary T. Experimental atherosclerosis in rabbit compared with human (coronary) atherosclerosis. Arch Pathol 1934;17:453–92.
Loree HM, Kamm RD, Atkinson CM, et al. Turbulent pressure fluctuations on surface of model vascular stenosis. Am J Physiol 1991;261:H644–50.
Loree HM, Kamm RD, Stringfellow RG, et al. Effects of fibrous cap thickness on peak circumferential stress in model atherosclerotic vessels. Circ Res 1992;71:850–8.
MacIsaac AI, Thomas JD, Topol EJ. Toward the quiescent coronary plaque. J Am Coll Cardiol 1993;22:1228–41.
Montenegro MR, Eggen DA. Topography of atherosclerosis in the coronary arteries. Lab Invest 1968;18:586–93.
Moreno P, Falk E, Palacios IF, et al. Macrophage infiltration in acute coronary syndromes: implications for plaque rupture. Circulation 1995;90:7758.
Peters RJG, Kok WEM, Bot H, et al. Characterization of plaque components with intracoronary ultrasound imaging: an in vitro qualitative study with videodensitometry. J Am Soc Echocardiogr 1994;7:616–23.
Ramo PM, Spencer T, Salter DM, et al. Can spectral analysis of unprocessed intravascular ultrasound signal identify intramural lipid pools? Circulation 1996;94:Suppl I:I-612. abstract.
Richardson PD, Davies MJ, Born GVR. Influence of plaque configuration and stress distribution on fissuring of coronary atherosclerotic plaques. Lancet 1989;2:941–4.
Ridolfi RL, Hutchins GM. The relationship between coronary artery lesions and myocardial infarcts: ulceration of atherosclerotic plaques precipating coronary thrombosis. Am Heart J 1977;93:468–86.
Sechtem U, Arnold G, Keweloh T, et al. In vitro diagnosis of coronary plaque morphology using intravascular ultrasound: comparison with histopathologic findings. Z Kardiol 1993;82:618–27.
Sinapius D. Relationship between coronary artery thrombosis and myocardial infarction. Dtsch Med Wochenschr 1972;97:443–8.
Stary HC, Chandler AB, Dinsmore RE, et al. A definition of advanced types of atherosclerotic lesions and a histological classification of atherosclerosis: a report from the Committee on Vascular Lesions of the Council on Atherosclerosis. American Heart Association. Circulation 1995;92:1355–74.
Tobis JM, Mallery J, Mahon D, et al. Intravascular ultrasound imaging of human coronary arteries in vivo. Circulation 1991;83:913–26.
van der Wal AC, Becker AE, van der Loos CM, et al. Site of intimal rupture or erosion of thrombosed coronary atherosclerotic plaques is characterized by an inflammatory process irrespective of the dominal plaque morphology. Circulation 1994;89:36–44.
Wilentz JR, Sanborn TA, Haudenschild CC, et al. Platelet accumulation in experimental angioplasty: time course and relation to vascular injury. Circulation 1987;75:636–42.
Zamorano J, Erbel R, Ge J, et al. Spontaneous plaque rupture visualized by intravascular ultrasound. Eur Heart J 1994;15: 131–3.
Author information
Authors and Affiliations
Corresponding author
Additional information
The authors have retracted this article as it contains large portions of text and figures that have been previously published in Ge J, Chirillo F, Schwedtmann J, Görge G, Haude M, Baumgart D, Shah V, von Birgelen C, Sack S, Boudoulas H, Erbel R (1999) Screening of ruptured plaques in patients with coronary artery disease by intravascular ultrasound. Heart 81:621–627.
An erratum to this article is available at http://dx.doi.org/10.1007/s00059-013-4016-7.
About this article
Cite this article
Ge, J., Baumgart, D., Haude, M. et al. RETRACTED ARTICLE: Role of intravascular ultrasound imaging in identifying vulnerable plaques. Herz 24, 32–41 (1999). https://doi.org/10.1007/BF03043816
Published:
Issue Date:
DOI: https://doi.org/10.1007/BF03043816