Summary
An optimum release of 5′-nucleotides in Bintje potato homogenates occurs at 52°C and pH 6.0. At higher temperatures there is an accumulation of 3′-nucleotides and oligonucleotides; at lower temperatures and lower pH-values there is an accumulation of nucleosides and further degradation products. Optimum activities in enzyme raw extract are reported for phosphodiesterase I (50°C, pH 5.5), phosphodiesterase II (60°C, pH 5.5), ribonuclease (70°C, pH 5.0), phosphatase (45–50°C, pH 5.0), phosphatase +5′-nucleotidase (45–50°C, pH 5.0). The relationship between the total enzymatic activities and the formation of 5′-nucleotides during cooking of potatoes is discussed.
Zusammenfassung
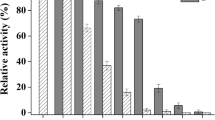
5′-Nukleotide wirken in Lebensmitteln als geschmacksverstärkende Verbindungen. Buri et al. (1970) hat bereits früher auf die Bedeutung dieser Verbindungen für den Geschmack von Kartoffeln hingewiesen und konnte zeigen, dass 5′-Nukleotide während des Kochprozesses aus Ribonukleinsäure (RNS) gebildet werden. Eine chemische Hydrolyse von RNS zu 5′-Nukleotiden kann ausgeschlossen werden; somit kommt nur eine enzymatische Freisetzung in Frage. Diese wird in der vorliegenden Arbeit untersucht. Es wurde aus Bintje-Kartoffeln ein vorgereinigter enzymatischer Extrakt hergestellt und dessen Enzymaktivitäten wurden zunächst mit spezifischen Substraten charakterisiert. Ribonuklease wurde mit zyklischem 2′, 3′-Cytidinmonophosphat gemessen und ergab optimale Aktivitäten bei 70°C und pH 5.0 (Abb. 1 und 2). Phosphodiesterase I, untersucht mit dem Substrat α-Naphthyl-Thymidin-5′-Monophosphat, ergab optimale Aktivitäten bei 50°C und pH 5.5 (Abb. 3 und 4). Phosphodiesterase II wurde mit Thymidin-5′-Monophosphat-p-Nitrophenylester geprüft und zeigte optimale Aktivitäten bei 60°C und pH 5.5 (Abb. 5 und 6). Phosphatase wurde mit p-Nitrophenylphosphat gemessen und zeigte Optima der Aktivität bei 45–50°C und pH 5.0 (Abb. 7 und 8). Schliesslich konnte die gesamte Aktivität von Phosphatase und 5′-Nukleotidase gemeinsam mit dem Substrat 5′-Adenosinmonophosphat bestimmt werden, mit optimalen Aktivitäten bei 45–50°C und pH 5.0 (Abb. 9 und 10).
Sodann wurde mit RNS als Substrat die Anreicherung löslicher Abbauprodukte im Bereich von 40–70°C und pH 4.0–7.0 untersucht. Dabei wurden 3′-Nukleotide, 5′-Nukleotide und Nukleoside getrennt erfasst. Die Resultate sind in Tabelle I zusammengestellt und zeigen das folgende. Die Freisetzung von Nukleotiden ist optimal bei 50°C und pH 6.0; es handelt sich vor allem um 5′-Nukleotide. Die Reaktion ist abhängig vom pH. 3′-Nukleotide werden erst bei Temperaturen von über 50°C freigesetzt, mit einem Optimum bei 70°C und pH 5.0. Nukleoside bilden sich bevorzugt bei 50°C und pH 5.0–5.5.
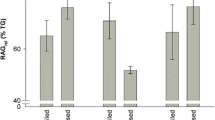
Auf Grund dieser Ergebnisse wurde ein Kartoffelhomogenisat hergestellt und autoinkubiert; bei 52°C und pH 6.0 ergab sich eine maximale Freisetzung von 5′-Nukleotiden (Tab. 2).
Aus diesen Ergebnissen kann geschlossen werden, dass ein spezifischer RNS-Abbau in der Kartoffel bis zu Temperaturen von 50°C bevorzugt durch das Enzym Phosphodiesterase I erfolgt, unter Bildung von 5′-Nukleotiden. Ribonuklease wird erst bei höheren Temperaturen aktiv, sofern noch genügend Substrat vorhanden ist. Dabei ist auch der pH-Wert der Knollen von Bedeutung. Die freigesetzten 5′-Nukleotide sind stabil, weil die entsprechenden Nukleotidabbauenden Enzyme eine stark verschiedene pH-Abhängigkeit ihrer Aktivitäten aufweisen. Die Knollenform und die damit verbundenen Kochzeiten sind sicherlich ein wichtiger Faktor, der diese enzymatischen Vorgänge beeinflusst.
Abschliessend kann festgestellt werden, dass nicht nur das Enzymsystem, sondern auch das pH der Knolle und die Temperaturverhältnisse während der Verarbeitung für die spezifische Freisetzung von 5′-Nukleotiden in zubereiteten Kartoffeln von Bedeutung sind.
Résumé
Les 5′-nucléotides sont d'importants renforcateurs de goût dans les denrées alimentaires. Buri et coll. (1970) ont déjà mis en évidence l'influence de ces composés sur le goût des pommes de terre et ont montré que les 5′-nucléotides se forment pendant la cuisson à partir d'acide ribonucléique (ARN). Une hydrolyse chimique de l'ARN libérant les 5′-nucléotides a pu être exclue, de sorte que seul un processus enzymatique peut être envisagé, lequel fait l'objet du présent travail. Un extrait enzymatique purifié a été préparé à partir de pommes de terre Bintje et son activité caractérisée à l'aide de substrats spécifiques. La ribonucléase, en présence de 2′, 3′-cytidine-monophosphate cyclique, a donné des activités optimales à 70°C et pH 5.0 (fig. 1 et 2). La phosphodiestérase I examinée avec le substrat α-naphtylthymidine-5′-monophosphate a présenté des optimums d'activité à 50°C et pH 5.5 (fig. 3 et 4). Les activités optimales de la phosphodiestérase II ont été situées à 60°C et pH 5.5 en présence de thymidine-5′-monophosphate-p-nitrophénylester (fig. 5 et 6). La phosphatase en présence de p-nitrophénylphosphate a donné des optimums d'activité à 45–50°C et pH 5.0 (fig. 7 et 8). Enfin, l'activité globale de la phosphatase et de la 5′-nucléotidase réunies a été déterminée avec le substrat 5′-adénosine-monophosphate, les optimums se situant à 45–50°C et pH 5.0 (fig. 9 et 10).
Puis, en prenant l'ARN comme substrat, l'enrichissement en produits de dégradation solubles a été étudié entre 40 et 70°C et pH 4.0 et 7.0. Ces produits de dégradation, 3′-nucléotides, 5′-nucléotides et nucléosides ont été déterminés séparément et les résultats présentés dans le tableau 1. Il ressort de ces résultats que la libération de nucléotides, principalement des 5′-nucléotides, est optimale à 50°C et pH. 6.0 et que la réaction est dépendante du pH. Les 3′-nucléotides ne sont libérés qu'à des températures supérieures à 50°C avec un optimum à 70°C et pH 5.0–5.5.
Sur la base de ces résultats, un homogénéisat de pommes de terre a été préparé et autoincubé; à 52°C et pH 6.0, on observe une libération maximale de 5′-nucléotides (tableau 2).
On peut en conclure qu'il se produit une dégradation spécifique de l'ARN dans la pomme de terre jusqu'à une température de 50°C, due principalement à la phosphodiestérase I avec formation de 5′-nucléotides. La ribonucléase ne devient active qu'à des températures supérieures et pour autant qu'il reste suffisamment de substrat. Le pH des tubercules joue également un rôle. Les 5′-nucléotides libérés sont stables, les enzymes dégradant les nucléotides ayant des activités qui varient de manière très diverses avec le pH. La forme des tubercules, ainsi que les temps de cuisson qui en découlent, sont certainement un facteur important pouvant influencer ces processus enzymatiques.
Finalement, et on peut constater que non seulement le système enzymatique, mais également le pH du tubercule et les températures mises en oeuvre pendant la préparation des pommes de terre ont une incidence sur la libération des 5′-nucléotides dans celles-ci.
Similar content being viewed by others
References
Anfinsen, C. B., R. R. Redfield, W. L. Choate, J. Page & W. R. Carroll, 1954. Studies on the gross structure, cross-linkage and terminal sequences in ribonuclease.J. biol. Chem. 207: 201–210.
Bartolome, L. G. & J. E. Hoff, 1972. Firming of potatoes: biochemical effects of preheating.J. agric Fd Chem. 20: 266–270.
Björk, W., 1965. Purification of two endonucleases from potato tubers.Biochem. biophys. Acta 95: 652–662.
Buri, R., V. Signer & J. Solms, 1970. Die Bedeutung von freien Aminosäuren und Nukleotiden für den Flavor von gekochten Kartoffeln.Lebensm.-Wiss-u. Technol. 3: 63–66.
Buri, R. & J. Solms, 1971. Ribonucleic acid—a flavor precursor in potatoes.Naturwissenschaften 58: 56.
Crook, E. M., A. P. Mathias & B. R. Rabin, 1960. Spectrophotometric assay of bovine pancreatic ribonuclease by the use of cytidine 2′, 3′-phosphate.Biochem. J. 74: 234–238.
Dumelin, E., 1975. Die Bedeutung des RNS-abbauenden Enzymsystems für die Anreicherung von 5′-Nukleotiden in Kartoffeln. Diss. ETH 5511, Zurich.
Duncan, D. B., 1955. Multiple range and multiple F tests.Biometrics 11: 1–42.
Duncan, H. J. & W. R. Rees, 1972. Studies on nucleotides and related compounds in plants. III.J. Sci. Fd Agric. 23: 353–357.
Helferich, B. & H. Stetter, 1947. Zur Kenntnis der Kartoffel-Phosphatase.Liebigs Ann. Chem. 558: 234–241.
Hyde, R. B. & J. W. Morrison, 1964. Whe effect of storage temperature on reducing sugars, pH and phosphorylase enzyme activity in potato tubers.Am. Potato J. 41: 163–168.
Iritani, W. M. & L. Weller, 1974. Some factors influencing the pH of apical and basal portions of Russet Burbank and Norgold Russet potatoes.Am. Potato J. 51: 119–125.
Josefsson, L. & S. Lagerstedt, 1962. Characterization of ribonuclease and determination of its activity. In: D. Glick (Ed.), Methods of biochemical analysis 9: 39–74. Interscience Publ. New York.
Klein, W., 1957. Kinetische Eigenschaften. Spezifität und Verhalten gegenüber Hemmstoffen. Ueber Kartoffel-Nukleotidase, II. MitteilungZ. Physiol. Chem. 307: 254–262.
Kornberg, A. & W. E. Pricer, 1950. On the structure of triphosphopyridine nucleotide.J. biol. Chem. 186: 557–567.
Kubicz, A., B. Morawiecka & M. Kruzel, 1974. Heterogeneity of acid phosphatase from potato tubers.Acta Biochem. pol. 21: 113–117.
Lerch, B., 1968. Phosphodiesterase I. Spezifischer Nachweis nach Disk-Elektrophorese und Vorkommen in Pflanzen.Experientia 24: 889–890.
Linhardt, K. & K. Walter, 1962. In: H. U. Bergmeier (Ed.), Methoden der enzymatischen Analyse p. 779–787. Verlag Chemie GmbH, Weinheim.
Mouri, T., W. Hashida & I. Shiga, 1965. Changes of nucleic acid related substances during the processing of edible mushrooms.J. Ferment. Technol. 43: 344–351.
Mouri, T., W. Hashida & I. Shiga, 1966. Nucleic acid degrading enzymes of Shii-take.J. Ferment. Technol. 44: 248–258.
Mouri, T., W. Hashida, I. Shiga & S. Teramoto, 1968. Nucleic acid degrading enzymes of asparagus.J. Ferment. Technol. 46: 132–140.
Mouri, T., W. Hashida & I. Shiga, 1972. Nucleic acid degrading enzymes of sweet corn.J. Ferment. Technol. 50: 244–249.
Ohta, S., S. Maul, A. J. Sinskey & S. R. Tannenbaum, 1971. Characterisation of a heat-shock process for reduction of the nucleic acid content ofCandida utilis.Appl. Microbiol. 22: 415–421.
Rauen, H. M., 1964. Biochemisches Taschenbuch.
Razzell, W. E., 1961. Tissue and intrazellular distribution of two phosphodiesterases.J. biol. Chem. 236: 3028–3030.
Razzell, W. E., 1966. Plant tissue phosphodiesterase activities.Biochem. biophys. Res. Commun. 22: 243–247.
Rees, W. R. & H. J. Duncan, 1972. Studies on nucleotides an related compounds in plants. I and II.J. Sci. Fd Agric. 23: 337–343, 345–351.
Seligman, A. M., H. H. Chauncy, M. M. Nachlass, L. H. Manheimer & H. A. Ravin, 1951. Determination of phosphatases in human serum.J. biol. Chem. 190: 7–15.
Solms, J., 1971. Nonvolatile compounds and the flavor of foods. In: G. Ohloff & A. F. Thomas (Eds), Gustation and olfaction. Academic Press, N.Y., p. 92–110.
Udvardy, J., E. Marré & G. L. Farkas, 1970. Purification and properties of a phosphodiesterase fromAvena leaf tissues.Biochem. biophys. Acta 206: 392–403.
Wilson, C. M., 1968. Plant nucleases. I. Separation and purification of two ribonucleases and one nuclease from corn.Plant. Physiol. 43: 1332–1338.
Author information
Authors and Affiliations
Rights and permissions
About this article
Cite this article
Dumelin, E., Solms, J. The formation of 5′-nucleotides during cooking of potatoes. Potato Res 19, 215–228 (1976). https://doi.org/10.1007/BF02365712
Accepted:
Issue Date:
DOI: https://doi.org/10.1007/BF02365712