Summary
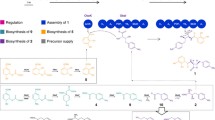
The synthesis of the antibiotic novobiocin is described. First the essential carbohydrate, the 3-O-carbamoylnoviose was synthesized fromd-glucose. A number of steps (1–6) led to the 3,5,6-tri-O-benzyl-2-O-methyl-d-galactono-γ-lactone (6) which is characterized by the correct array of carbon atoms inherent to the noviose. Further transformations (7–15) finally yielded the carbohydrate. The problem of glycosidation is discussed in some detail. Glycosidation of a suitable aglycon precursor (18) with 2,3-O-carbonyl-β-noviosyl-chloride (22) proved possible and led to the isolation of anα-glycoside (23) which was further transformed (24–28) into novobiocin.
Similar content being viewed by others
Literatur
H. Wallick, D. A. Harris, M. A. Reagan, M. Ruger undH. B. Woodruff, Antibiotics Annual1955–56, 909.
M. Finland, Antibiotics Annual1955–56, 929.
F. K. Lin undL. L. Coriell, Antibiotics Annual1955–56, 634.
H. Welch undW. W. Wright, Antibiotics and Chemotherapy5, 670 (1955).
G. Rolland et al., Farmaco [Pavia] Ediz. sci.1, 549 (1956), berichteten am IX. Kongress der Mikrobiologie in Palermo (April 1956) ebenfalls über eine neue Streptomycesgattung. Das Antibioticum, S-800, das dieser Mikroorganismus produzierte, erwies sich in der Folge als identisch mit Novobiocin.
Antibiotic Med.2, 172 (1956).
C. H. Shunk, C. H. Stammer, E. A. Kaczka, E. Walton, C. F. Spencer, A. N. Wilson, J. W. Richter, F. W. Holly undK. Folkers, J. Amer. chem. Soc.78, 1770 (1956).
J. W. Hinman, E. L. Caron undH. Hoeksema, J. Amer. chem. Soc.79, 3789 (1957).
E. Walton, J. O. Rodin, F. W. Holly, J. W. Richter, C. H. Shunk undK. Folkers, J. Amer. chem. Soc.82, 1489 (1960).
E. Walton, J. O. Rodin, C. H. Stammer, F. W. Holly undK. Folkers, J. Amer. chem. Soc.78, 5454 (1956).
H. Hoeksema, E. L. Caron undJ. W. Hinman, J. Amer. chem. Soc.78, 2019 (1956).
E. Walton, J. O. Rodin, C. H. Stammer, F. W. Holly undK. Folkers, J. Amer. chem. Soc.80, 5168 (1958).
P. A. Levene undJ. Compton, J. Amer. chem. Soc.57, 2306 (1935); J. biol. Chem.116, 169 (1936).
H. Hoeksema, J. L. Johnson undJ. W. Hinman, J. Amer. chem. Soc.77, 6710 (1955).
J. W. Hinman, H. Hoeksema, E. L. Caron undW. G. Jackson, J. Amer. chem. Soc.78, 1072 (1956).
C. F. Spencer, J. O. Rodin, E. Walton, F. W. Holly undK. Folkers, J. Amer. chem. Soc.80, 140 (1958).
C. S. Hudson, J. Amer. chem. Soc.31, 66 (1909).
A. J. Birch, P. W. Holloway undR. W. Rickards, Biochim. biophys. Acta57, 143 (1962).
F. Weygand undO. Trauth, Chem. Ber.85, 57 (1952).
S. Winstein, L. Goodman undR. Boschan, J. Amer. chem. Soc.72, 2311 (1950).
S. Winstein undR. Boschan, J. Amer. chem. Soc.72, 4669 (1950).
B. P. Vaterlaus undH. Spiegelberg, Helv. chim. Acta46, in Vorbereitung.
W. A. Bonner, Advances Carbohydrate Chem.6, 251 (1951).
Wanderungen von aliphatischen Acylgruppen, die meistens alkalikatalysiert sind, wurden in veresterten Polyhydroxyverbindungen oft beobachtet (K. Josephson, Ber. deutsch. chem. Ges.63, 3089 (1930), und dort zitierte Ref.).
C. M. McCloskev, Advances Carbohydrate Chem.12, 148 (1957).
A. S. Perlin, Advances Carbohydrate Chem.14, 9 (1959).
J. Conchie, G. A. Levvy undC. A. Marsh, Advances Carbohydrate Chem.12, 173 (1957).
R. W. Jeanloz, H. G. Fletcher Jr. undC. S. Hudson, J. Amer. chem. Soc.70, 4055 (1948).
J. Conchie, G. A. Levvy undC. A. Marsh, Advances Carbohydrate Chem.12, 157 (1957).
L. J. Haynes undF. H. Newth, Advances Carbohydrate Chem.10, 207 (1955).
E. Pacsu, Advances Carbohydrate Chem.1, 77 (1945).
H. S. Isbell undH. L. Frush, J. Res. nat. Bur. Standards43, 161 (1949).
R. K. Ness, H. G. Fletcher Jr. undC. S. Hudson, J. Amer. chem. Soc.72, 2200 (1950);73, 959 (1951).
R. U. Lemieux, Advances Carbohydrate Chem.9, 1 (1954).
P. A. J. Gorin undA. S. Perlin, Canad. J. Chem.39, 2474 (1961).
S. Winstein undR. E. Buckles, J. Amer. chem. Soc.65, 613 (1943).
Das Ion gibt Anlass zur oft beobachteten Orthoesterbildung in dieser Reaktion. Die Reaktionsbedingungen sind weitgehend produktbestimmend (R. K. Ness, H. G. Fletscher Jr. undC. S. Hudson, J. Amer. chem. Soc.73, 296 (1951)).
Löste man die Verbindung16 in absolutem Methanol, so kristallisierte das Ausgangsmaterial, das Methyl-α-noviosid-Derivat13 aus dem Reaktionsmilieu. Dieses Resultat steht somit in direkter Analogie zum sterisch verwandten 2,3,4-Tri-O-benzoyl-α-d-lyxopyranosylbromid (H. G. Fletcher Jr., R. K. Ness undC. S. Hudson, J. Amer. chem. Soc.73, 3698 (1951)).
R. E. Reeves, J. Amer. chem. Soc.72, 1499 (1950).
S. Winstein undR. M. Roberts, J. Amer. chem. Soc.75, 2297 (1953).
R. U. Lemieux undG. Huber, Canad. J. Chem.33, 128 (1955).
W. Koenigs undE. Knorr, Ber. deutsch. chem. Ges.34, 957 (1901).
Es wurde erfolglos versucht, die Verbindung16 durch das sterisch verwandte 2,3,4,6-Tetra-O-benzoyl-α-d-mannosylbromid (R. K. Ness, H. G. Fletcher Jr. undC. S. Hudson, J. Amer. chem. Soc.72, 2200 (1950)) zu ersetzen und so die Glycosidierung mit der Substanz18 auszuführen.
D. H. Brauns, J. Amer. chem. Soc.47, 1280 (1925).
H. Ohle, W. Marecek undW. Bourjau, Ber. deutsch. chem. Ges.62, 833 (1929).
M. Gehrke undF. X. Aichner, Ber. deutsch. chem. Ges.60, 918 (1927).
Eine erfolgreiche Anwendung desselben Gedankenganges findet man in der Synthese des 2,3-O-Carbonyl-α-d-ribofuranose-1-phosphats vor (G. M. Tener undH. G. Khorana, J. Amer. chem. Soc.79, 437 (1957).
G. M. Tener, R. S. Wright undH. G. Khorana, J. Amer. chem. Soc.79, 441 (1957)).
Die Ansicht, dass die bicyclischen 2,3-O-Carbonyl-noviosylhalogenide im Gegensatz zu den diacylierten Noviosylhalogeniden in bimolekularer Art reagieren können, somit Inversion am C-1 gewährleistet ist, lässt sich in Analogie zu der Reaktionsweise des 4,6-Di-O-acetyl-2,3-O-carbonyl-α-mannosylbromids (P. A. J. Gorin undA. S. Perlin, Canad. J. Chem.39, 2474 (1961)) vertreten. Es kann dies die Folge des angegliederten Cyclocarbonat-Fünfringes sein, der die ursprüngliche Sesselkonformation45,46 des Moleküls so verändert, dass ein stabilisiertes, planares Carboniumion als Reaktionszwischenstufe wenig wahrscheinlich ist.
S. J. Angyal undC. G. MacDonald, J. chem. Soc.1952, 686.
E. L. Eliel undC. Pillar, J. Amer. chem. Soc.77, 3600 (1955).
A. Furlenmeier, C. v.Planta undB. P. Vaterlaus, Kurzreferat am XIXth International Congress of Pure and Applied Chemistry, 10.–17. Juli (1963), London.
J. W. Hinman, E. L. Caron undH. Hoeksema, J. Amer. chem. Soc.79, 5321 (1957).
Brit. Pat. 878907 (Upjohn Co., Kalamazoo Mich., USA).
Additional information
Chemische Forschungsabteilung der F. Hoffmann-La Roche & Co. AG, Basel.
Vortrag Dr.B. P. Vaterlaus, gehalten an der Gordon Research Conference on Steroids and other Natural Products, 16.–20. Juli 1962, New Hampton, N.H., USA, und vor der Basler Chemischen Gesellschaft, 8. November 1962. Im Auszug:H. Spiegelberg,Synthèse du 3-O-carbamoylnoviose, sucre de la novobiocine, Symposium international de chimie organique, Bruxelles, 15. Juni 1962;J. Kiss,The Synthesis of Noviose and Allied Compounds, Birkbeck College (Univ. London), 23. Oktober 1962. Der vorliegende Aufsatz ist Gegenstand von Detailpublikationen in den Helv. chim. Acta, in Vorbereitung (1963).
Rights and permissions
About this article
Cite this article
Vaterlaus, B.P., Doebel, K., Kiss, J. et al. Die Synthese des Novobiocins. Experientia 19, 383–391 (1963). https://doi.org/10.1007/BF02171500
Published:
Issue Date:
DOI: https://doi.org/10.1007/BF02171500