Abstract
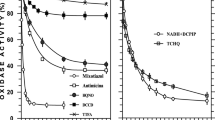
The ability to oxidize nicotinic acid enzymatically is widespread in the speciesMycobacterium smegmatis. On Löwenstein-Jensen medium grown resting cells of this species oxidize nicotinic acid only after a pronounced lag, whereas resting cells grown on Löwenstein-Jensen medium with the addition of nicotinic acid oxidize the homologous substrate immediately, thus indicating that the oxidation system is an inducible one. Further inducing agents are nicotineamide, 6-hydroxynicotinic acid, and α-ketoglutaric acid, but not 2-hydroxynicotinic acid, 2,6-dihydroxypyridine, 2,5-dihydroxypyridine, succinic acid, fumaric acid, and maleic acid. Purified cell free extracts of nicotinic acid grown cells (nicotinic acid hydroxylase) catalyze the oxidation of nicotinic acid with the uptake of 0,5 µmole of oxygen per µmole of substrate. But it is necessary that electron acceptors such as methylene blue, NAD or TTC are present. The reaction product is 6-hydroxynicotinic acid, which was isolated and identified by different methods (ultraviolet absorption spectra, melting point, chromatography). Because of the requirement for electron acceptors, the reactions leading to the formation of 6-hydroxynicotinic acid must involve a dehydrogenation step. The oxygen of the product must have its origin in water oxygen rather than molecular oxygen. It can be concluded that 6-hydroxy-5,6-dihydronicotinic acid is the intermediate of the mycobacterial oxidation of nicotinic acid to 6-hydroxynicotinic acid.
Further intermediates of the enzymatic degradation of nicotinic acid byMycobacterium smegmatis are 2,3,6-trihydroxypyridine and α-ketoglutaric acid.
Zusammenfassung
Die Fähigkeit, Nicotinsäure enzymatisch abzubauen, ist in der SpeciesMycobacterium smegmatis weit verbreitet. Ruhende Zellen von Stämmen dieser Species, die auf Löwenstein-Jensen-Nährböden vorgezüchtet worden sind, oxydieren Nicotinsäure erst nach einer längeren „lag“-Phase, während ruhende Zellen der gleichen Stämme, wenn sie auf nicotinsäurehaltigem Löwenstein-Jensen-Nährboden gezüchtet worden sind, das homologe Substrat sofort oxydieren. Die enzymatische Oxydation der Nicotinsäure ist somit induzierbar. Weitere induzierende Agentien sind Nicotinamid, 6-Hydroxynicotinsäure und α-Ketoglutarsäure, dagegen nicht 2-Hydroxynicotinsäure, 2,6-Dihydroxypyridin, 2,5-Dihydroxypyridin, Bernsteinsäure, Fumarsäure und Maleinsäure. Es wurden gereinigte zellfreie Extrakte (Nicotinsäurehydroxylase) des StammesMycobacterium smegmatis SN 2, der auf nicotinsäurehaltigem Löwenstein-Jensen-Nährboden vorgezüchtet worden war, hergestellt. Diese Extrakte katalysieren die Oxydation von Nicotinsäure unter Aufnahme von 0,5 µmol Sauerstoff pro µmol Substrat. Dabei ist die Anwesenheit von Elektronenacceptoren wie Methylenblau, NAD oder TTC erforderlich. Das Reaktionsprodukt ist 6-Hydroxynicotinsäure, die unter Anwendung verschiedener Methoden isoliert und identifiziert werden konnten. Da die Anwesenheit von Elektronenacceptoren erforderlich ist, muß an den Reaktionen, die zur Bildung von 6-Hydroxynicotinsäure führen, eine Dehydrogenierung beteiligt sein. Der Sauerstoff des Reaktionsprodukts wird sehr wahrscheinlich dem Wasser entnommen und nicht dem Sauerstoff der Luft. Als Zwischenprodukt der mykobakteriellen Oxydationen der Nicotinsäure zu 6-Hydroxynicotinsäure wird 6-Hydroxy-5,6-dihydronicotinsäure angenommen. Weitere Intermediärprodukte des enzymatischen Abbaues von Nicotinsäure durchMycobacterium smegmatis sind 2,3,6-Trihydroxypyridin und α-Ketoglutarsäure.
Similar content being viewed by others
Literatur
Behrman, E. J., Stanier, R. Y.: Observations on the oxidation of halogenated nicotinic acids. J. Biol. Chem.228, 947 (1957).
—— —— The bacterial oxidation of nicotinic acid. J. Biol. Chem.228, 923 (1957).
Bönicke, R.: Beschreibung der neuen Species Mycobacterium borstelense n. spec. Zbl. Bakt., I. Abt. Orig.196, 535 (1965).
Ensign, J. C.: The bacterial metabolism of pyridine, 2-hydroxypyridine and nicotinic acid. Dissertation, University of Southern California, 1963.
—— Rittenberg, S. C.: The pathway of nicotinic acid oxidation by a Bacillus species. J. Biol. Chem.239, Nr. 7, 2285 (1964).
Gale, G. R.: The oxidation of benzoic acid by Mycobacteria. I. Metabolic pathways in Mycobacterium tuberculosis, Mycobacterium butyricum and Mycobacterium phlei. J. Bact.63, 273 (1952).
—— The oxidation of benzoic acid by Mycobacteria. II. The metabolism of postulated intermediates in the benzoate oxidation chain by four avirulent and two virulent organisms. J. Bact.64, 131 (1952).
Harary, I.: Bacterial fermentation of nicotinic acid. I. End products. J. Biol. Chem.227, 815 (1957).
Harary, I.: Bacterial fermentation of nicotinic acid. II. Anaerobic reversible hydroxylation of nicotinic acid to 6-hydroxynicotinic acid. J. Biol. Chem.227, 823 (1957).
Hughes, D. E.: 6-Hydroxynicotinic acid as an intermediate in the oxidation of nicotinic acid by Pseudomonas fluorescens. Biochem. J.60, 303 (1955).
Hunt, A. L.: Purification of the nicotinic acid hydroxylase system of Pseudomonas fluorescens KB1. Biochem. J.72, 1 (1958).
—— Hughes, D. E., Lowenstein, J. M.: The hydroxylation of nicotinic acid by Pseudomonas fluorescens. Biochem. J.69, 170 (1958).
König, W.: Über eine neue, vom Pyridin derivierende Klasse von Farbstoffen. J. prakt. Chem.69, 105 (1904).
—— Zur Kenntnis der Pyridinfarbstoffe. J. prakt. Chem.70, 19 (1904).
Konno, K.: New chemical method to differentiate human type tubercle bacilli from other mycobacteria. Science124, 985 (1956).
Pinsky, A., Michaelis, M.: The oxidation of nicotinic acid by Pseudomonas fluorescens. Biochem. J.52, 33 (1952).
Pope, H., Smith, D. T.: Synthesis of B-complex vitamins by tubercle bacilli when grown on synthetic media. Amer. Rev. Tuberc.54, 559 (1946).
Sistrom, W. R., Stanier, R. Y.: The mechanism of catechol oxidation by Mycobacterium butyricum. J. Bact.66, 404 (1953).
Stanier, R. Y.: Simultaneous adaption: a new technique for the study of metabolic pathways. J. Bact.54, 339 (1947).
Author information
Authors and Affiliations
Rights and permissions
About this article
Cite this article
Bönicke, R., Ewoldt, A. & Röhrscheidt, E. Untersuchungen über die induktive Nicotinsäurehydroxylase-Bildung bei Mycobacterium smegmatis. Pneumologie 142, 173–181 (1970). https://doi.org/10.1007/BF02095213
Issue Date:
DOI: https://doi.org/10.1007/BF02095213