Summary
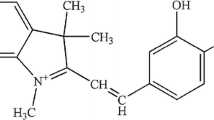
The selective binding of optically active dyes to bovine serum albumin has been investigated at two temperatures. The optically active dyes were derived fromD andL-alamine, and their binding behaviors have been examined by dialysis experiments and measurement of absorption spectra of bound dyes. It has been found that theD-form of the dyes bound with the albumin more tightly thant theL-form did within the range ofph 5.0 toph 8.0. Atph 4.0, however no differences in the binding behaviors were detected between the optical isomers. From the thermodynamic study, it has been recognized that the entropy changes associated with the binding process are positive, and the positive entropy changes of theD-form binding are larger than those of theL-form atph 5.0. The existence of two factors responsible for the positive entropy changes are discussed.
The spectral investigation suggests that it is helpful to observe carefully the interaction of the conjugated part of the dyes and BSA. The distinct spectral difference between the optical isomers bound with the protein, then intimate the existence of different states of the conjugated part of the isomers binding with BSA.
Zusammenfassung
Die selektive Bindung von optisch-aktiven Farbstoffen an Rinderserum-Alanin wurde bei zwei Temperaturen untersucht. Die optisch-aktiven Farbstoffe waren vomD-undL-Albumin abgeleitet, und ihr Bindungsverhalten wurde durch Dialyse-Experimente und Messungen der Absorptionsspektren gebundener Farbstoffe geprüft. Es wurde gefunden, daß dieD-Form der Farbstoffe mit dem Albumin engere Bindungen eingehen als dieL-Form innerhalb einesph-Berichs von 5 bis 8. Bei ph 4 jedoch konnte kein Unterschied in dem Bindungsverhalten der optischen Isomeren bemerkt werden. Von thermodynamischen Studien her ist bekannt, daß die Entropie-Änderungen gekoppelt mit den Bindungsprozessen positiv sind und daß die positiven Entropieänderungen derD-Bindung größer sind als die derL-Form beiph 5. Die Existenz von zweierlei Faktoren, verantwortlich für die positive Entropieänderung, wird diskutiert.
Spektrale Untersuchungen lassen vermuten, daß es nützlich ist, sorgfältig die Wechselwirkung der konjugierten Teile der Farbstoffe und des Rinderserum-Albumins zu beobachten. Die deutliche spektrale Differenz zwischen den optischen Isomeren, gebunden an das Protein läßt dann die Existenz verschiedener Zustände der gebundenen Teile der Isomeren bei der Bindung mit BSA vermuten.
Similar content being viewed by others
References
Koga, J., N. Morita, andN. Kuroki. Kolloid-Z. u. Z. Polymere (in press).
Klotz, I. andJ. Urquhart, J. Amer. Chem. Soc.71, 847 (1949).
Davis, B., J. Clin. Invest.22, 753 (1943).
Putnam, F. andH. Neurath, J. Biol. Chem.159, 195 (1945).
Koga, J. andN. Kuroki, Kolloid-Z. u. Z. Polymere (in press).
Klotz, I., F. Walker, andR. Pivan, J. Amer. Chem. Soc.68, 1468 (1946).
Klotz, I., The Protein (New York 1952).
Karush, F., J. Amer. Chem. Soc.71, 1369 (1949),72, 2705, 2714 (1950),73, 1246 (1951),76, 5536 (1954), J. Phys. Chem.56, 70 (1952).
Putnam, F. andH. Neurath, J. Biol. Chem.150, 263 (1943).
Brand andSuidel, J. Clin. Invest.23, 437 (1944).
Burkhard, R., R. Bauer, andR. Grossman, J. Amer. Chem. Soc.79, 3209 (1957).
Krasner, J. andP. McMenamy, J. Biol. Chem.241, 4186 (1966).
Markus, G. andF. Karush, J. Amer. Chem. Soc.79, 3264 (1957)80, 89 (1958).
Forbes, W., B. Harrap, andB. Milligan, Australian J. Chem.5, 83 (1962).
Silverstein, R., Spectrometric Identification of Organic Compounds, p. 101 (New York 1963).
Author information
Authors and Affiliations
Additional information
With 4 figures and 9 tables
Rights and permissions
About this article
Cite this article
Koga, J., Morita, N. & Kuroki, N. The binding of optically active compounds with proteins. Kolloid-Z.u.Z.Polymere 236, 68–76 (1970). https://doi.org/10.1007/BF02084515
Received:
Issue Date:
DOI: https://doi.org/10.1007/BF02084515