Summary
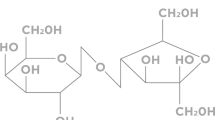
For the sake of metabolic insight into the fate of the sugar substitute Palatinit®, its two components D-glucosyl-α(1→1)-D-mannitol and D-glucosyl-α(1→6)-D-glucitol [D-glucosyl-α-(1→6)-D-sorbitol] were assayed for glucose bioavailability by the procedure of Karimzadegan et al. using ketotic rats. With conversion rates into glucose of 6 and 20 %, respectively, for free mannitol and glucitol (sorbitol), 39 % for glucosylmannitol and 42 % for glucosylglucitol, the metabolic glucose pool of the rat does not receive the full carbohydrate complement of these compounds. The preformed glucose moiety of the glucosylhexitols is bioavailable by 36 and 32 %, respectively, from glucosylmannitol and glucosylglucitol, with 50 % as theoretical maximum.
Less than theoretical bioavailability of glucose from Palatinit® is ascribed to microbial attack in the hindgut. The data on rats are held valid also for other species demonstrating carbohydrate fermentation in the caecum and/or colon. Differences between D-glucosyl-α(1→1)-D-mannitol and D-glucosyl-α(1→6)-D-glucitol are caused by a differential delay of glucose absorption in the small intestine, also exerted by D-glucitol.
The deep metabolic insight offered by the glucose bioavailability assay into the fate of carbohydrates includes the mammal-microbial symbiosis in the large bowel. Since a rather complete survey of the metabolic consequences after their intake can be obtained, the assay system should be generally applied in assessments of food safety also of other sugar substitutes.
Zusammenfassung
Zur Vertiefung des Verständnisses vom Stoffwechsel des Zuckeraustauschstoffes Palatinit® wurden seine zwei Bestandteile D-Glucosyl-α(1→1)-D-mannit und D-Glucosyl-α(1→6)-D-glucit [D-Glucosyl-α(1→6)-D-sorbit] nach dem Verfahren von Karimzadegan et al. auf ihre Glucose-Bioverfügbarkeit an ketotischen Ratten untersucht. Bei Umwandlungsraten in Glucose von 6 bzw. 20 % für Mannit und Glucit (Sorbit) sowie von 39 bzw. 42% für Glucosylmannit und Glucosylglucit erhält demnach der metabolische Glucose-Pool nicht das volle Glucose-Äquivalent aus diesen Verbindungen. Von dem Anteil an präformierter Glucose in den Glucosylhexiten — theoretisches Maximum 50 % — sind nur 36 % aus Glucosylmannit bzw. 32 % aus Glucosylglucit bioverfügbar.
Die im Vergleich zur Theorie verminderte Bioverfügbarkeit von Glucose aus Palatinit® wird auf partiellen mikrobiellen Abbau in unteren Darmabschnitten zurückgeführt. Die an Ratten erhaltenen Ergebnisse werden auch für alle anderen Spezies gelten, welche in Caecum und/oder Colon Kohlenhydrate vergären. Die Unterschiede zwischen D-Glucosyl-α(1→1)-D-mannit und D-Glucosyl-α(1→6)-D-glucit werden durch unterschiedliche Verzögerung der Glucoseresorption im Dünndarm, wo auch D-Glucit angreift, bedingt.
Die Ermittlung der Glucose-Bioverfügbarkeit gewährt weitgehende Einblicke in das Schicksal von Kohlenhydraten einschließlich der Symbiose zwischen Säugetier und Mikroorganismen im Dickdarm. Da ein ziemlich vollständiger Überblick über die metabolischen Konsequenzen nach ihrer Zufuhr erhalten wird, sollte das Verfahren zur Messung der Bioverfügbarkeit von Glucose daher bei Abschätzungen der Lebensmittelsicherheit anderer Zuckeraustauschstoffe ebenfalls angewandt werden.
Similar content being viewed by others
References
Karimzadegan, E., A. J. Clifford, F. W. Hill: A Rat Bioassay for Measuring the Comparative Availability of Carbohydrates and Its Application to Legume Foods, Pure Carbohydrates and Polyols. J. Nutr.109, 2247–2259 (1979).
Lindner, H. J., F. W. Lichtenthaler: Extended Zigzag Conformation of 1-0-D-αglucopyranosyl-D-mannitol. Carbohydr. Res.93, 135–140 (1981).
Lichtenthaler, F. W., H. J. Lindner: The Preferred Conformations of Glucosylalditols. Liebigs Ann. Chem. 2372–2383 (1981).
Official Methods of Analysis, 10th ed., Assoc. Offic. Agr. Chemists, Washington, D.C., 1965, Sections 6.002 & 6.074.
Acker, L.: Nachweis und Bestimmung der Mono- und Oligosaccharide. pp. 349, in: Handbuch der Lebensmittelchemie, Hrsg.: J. Schormüller, Band II/2. Teil, Springer Verlag (Berlin 1967).
Bergmeyer, H. U., W. Gruber, J. Gutmann: D-Sorbit, in: Methoden der Enzymatischen Analyse (Hrsg.: H. U. Bergmeyer), 2. Aufl., S. 1292–1295, Verlag Chemie (Weinheim/Bergstr. 1970).
Roe, J. H.: The Determination of Sugar in Blood and Spinal Fluid with Anthrone Reagent. J. Biol. Chem.212, 335–343 (1955).
Finney, D. J.: Statistical Method in Biological Assay. Third Edition. pp. 159–162, Charles Griffin & Co. Ltd. (London and High Wycombe 1978).
Förster, H., B. Menzel: Untersuchung der intestinalen Glucoseresorption bei künstlich erhöhter Blutglucosekonzentration. Z. Ernährungswiss.11, 10–23 (1972).
Grupp, U., G. Siebert: Metabolism of Hydrogenated Palatinose, an Equimolar Mixture of α-D-Glucopyranosido-1,6-sorbitol and α-D-Glucopyranosido-1,6-mannitol. Res. Exp. Med. (Berl.)173, 261–278 (1978).
Zinner, P. M., M. Kirchgeßner: Zur energetischen Verwertung von Palatinit®. Z. Ernährungswiss.21, 272–278 (1982).
Kirchgeßner, M., P. M. Zinner, H. P. Roth: Energiestoffwechsel und Insulinaktivität bei Ratten nach Palatinitfütterung. Internat. J. Vit. Nutr. Res.53, 86–93 (1983).
Siebert, G., R. Vallon: Nutzung von Nahrungskohlenhydraten durch Darmbakterien. Dtsch. zahnärztl. Z.37, S42-S43 (1982).
Schnell-Dompert, E., G. Siebert: Metabolism of Sorbitol in the Intact Organism. Hoppe-Seyler's Z. Physiol. Chem.361, 1069–1075 (1980).
Cummings, J. H.: Short Chain Fatty Acids in the Human Colon. Gut22, 763–779 (1981).
Saunders, D. R., H. S. Wiggins: Conservation of Mannitol, Lactulose, and Raffinose by the Human Colon. Amer. J. Physiol.241 (Gastrointest. Liver Physiol.4). G 397-G 402 (1981).
Soergel, K. H.: Absorption of Fermentation Products from the Colon. Colon and Nutrition (Falk Symposium: 32), edited by H. Kasper and H. Goebell, pp. 27–34, MTP Press Limited, Falcon House, Lancaster (England 1982).
Roediger, W. E. W.: Role of Anaerobic Bacteria in the Metabolic Welfare of the Colonic Mucosa in Man. Gut21, 793–798 (1980).
Roediger, W. E. W.: Utilization of Nutrients by Isolated Epithelial Cells of the Rat Colon. Gastroenterology83, 424–429 (1982).
Jeffrey, G. A., H. S. Kim: Conformations of the Alditols. Carbohydr. Res.14, 207–216 (1970).
Author information
Authors and Affiliations
Additional information
Palatinit® is a registered trademark by Süddeutsche Zucker-A.G., Mannheim; generic name: Isomalt
Rights and permissions
About this article
Cite this article
Ziesenitz, S.C. Bioavailability of glucose from Palatinit® . Z Ernährungswiss 22, 185–194 (1983). https://doi.org/10.1007/BF02024693
Received:
Published:
Issue Date:
DOI: https://doi.org/10.1007/BF02024693