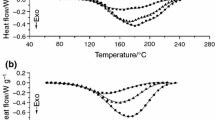
Abstract
The heat of reaction and kinetics of curing of diglycidyl ether of bisphenol-A (DGEBA) type of epoxy resin with catalytic amounts of ethylmethylimidazole (EMI) have been studied by differential power-compensated calorimetry as a part of the program for the study of process monitoring for composite materials. The results were compared with those from 1∶1 and 1∶2 molar mixtures of DGEBA and EMI. A method of determination of heat of reaction from dynamic thermoanalytical instruments was given according to basic thermodynamic principles. The complicated mechanism, possibly involving initial ionic formation, has also been observed in other measurements, such as by time-domain dielectric spectroscopy. The behavior of commercially available DGEBA resin versus purified monomeric DGEBA were compared. The melting point of purified monomeric DGEBA crystals is 41.4 °C with a heat of fusion of 81 J/g. The melt of DGEBA is difficult to crystallize upon cooling. The glass transition of purified DGEBA monomer occurs around −22 °C with aΔC p of 0.60 J/K/g.
Zusammenfassung
Reaktionswärme und Kinetik der Härtung von Diglycidylether des Bisphenol-A-Typs (DGEBA) von Epoxidharzen mit katalytischen Beimengungen von Ethylmethylimidazol (EMI) wurden als Teil eines Programms zur Untersuchung der Prozeßführung für Verbundstoffe untersucht. Die Ergebnisse werden mit den von DGEBA/EMI-Mischungen im molaren Verhältnis 1∶1 und 1∶2 verglichen. Eine Methode zur Bestimmung der Reaktionswärmen mit dynamischen thermoanalytischen Geräten nach grundlegenden thermodynamischen Prinzipien wird angegeben. Der komplizierte, möglicherweise durch eine Bildung von Ionen eingeleitete Mechanismus wurde ebenfalls bei anderen Messungen beobachtet, wie z. B. bei dielektrischer Spektroskopie. Das Verhalten von handelsüblichen DGEBA-Harzen wurde mit dem von gereinigtem monomerem DGEBA verglichen. Der Schmelzpunkt gereinigter Kristalle von monomerem DGEBA liegt bei 41,4 °C, die Schmelzwärme beträgt 81 kJ · g−1. Die Schmelze ist durch Abkühlung schwer zu kristallisieren. Der Glasübergang von gereinigtem DGEBA-Monomer erfolgt bei etwa −22 °C mit einemΔC p -Wert von 0,60 J K−1 g−1.
Резюме
Как часть программы п о изучению управлени я процессом получения композитных материалов, методом д ифференциальной кал ориметрии с энергетической комп енсацией была изучена теплота яеак ции и кинетика отверж дения эпокси смолы на основ е двойного эфира эпигидринового спир та и бис-фенола-А (ДГЕБ А) в присутствии каталит ических количеств этилметилимидазола (ЭМИ). Результаты были сопоставлены с таков ыми для полярных смес ей ДГЕБА ∶ ЭМИ равным 1∶1 и 1∶2. В соответствии с осн овными термодинамическими принципами, приведен метод опред еления теплоты реакц ии, исходя из данных динамических термоаналитических приборов. Сложный мех анизм, возможно включающий начальное ионное образование, наблюда лся также и в других ме тодах, таких как диэлектрич еская спектроскопия с временной компенсац ией. Сопоставлено пов едение продажных образцов с мол ДГЕБА и очищенных мономерны х образцов ДГЕБА. Для о чищенных мономерных кристалл ов ДГЕБА точка плавления 41,4 °С, а теплота плавления 81 дж /г. Расплав ДГЕБА трудно кристаллизуется при охлаждении. Темпе ратура стеклообразо вания очищенного мономера ДГЕБА наблюдается около −22 °С сΔС p равны м 0,60 дж/К/г.
Similar content being viewed by others
References
A. Farkas and P. F. Strohm, J. Appl. Polym. Sci., 12 (1968) 159.
J. M. Barton and P. M. Shepherd, Makrom. Chem., 176 (1975) 919.
F. Ricciardi, W. A. Romanchick and M. M. Juollie, J. Polym. Sci., 21 (1983) 1475.
J. M. Barton, Thermochim. Acta, 71 (1983) 337.
G. J. Rees, Vacuum, 26 (1976) 377.
R. S. Bauer, Shell Chemical Co., private communication.
J. L. Flippen-Anderson and R. Gilardi, Acta Cryst., B37 (1981) 1433.
H. E. Bair, ACS Polym. Prepr., 26 (1) (1985) 10.
D. A. Ditmars, S. Ishihara, S. S. Chang and G. Bernstein, J. Res. Nat. Bur. Stand., 87 (1982) 159.
G. T. Furukawa, R. E. McCoskey and G. J. King, J. Res. Nat. Bur. Stand., 47 (1951) 256.
S. S. Chang and A. B. Bestul, J. Chem. Phys., 56 (1972) 503.
J. M. O'Reilly and R. W. Connelly, Thermochim. Acta, 86 (1986) 231.
F. I. Mopsik, Rev. Sci. Instrum., 55 (1984) 79.
J. K. Gillham, Proc. Ann. Tech. Conf., Soc. Plast. Eng., 38 (1980) 268.
P. B. Prime, Ch. 6 “Thermosets”, in E. A. Turi, “Thermal Characterization of Polymeric Materials,” Acad. Press, 19,81.
Author information
Authors and Affiliations
Additional information
The author wishes to thank B. Dickens for the kind assistance on SEC measurements, F. I. Mopsik on time-domain dielectric spectroscopic measurements, K. M. Flynn on DSC measurements, and W. Su on purification and epoxy equivalent weight determinations.
Rights and permissions
About this article
Cite this article
Chang, S.S. Heat of reaction and curing of epoxy resin. Journal of Thermal Analysis 34, 135–154 (1988). https://doi.org/10.1007/BF01913380
Received:
Revised:
Issue Date:
DOI: https://doi.org/10.1007/BF01913380