Summary
Growing and differentiating cells ofMicrasterias denticulata Bréb., fixed with glutaraldehyde for 10–15 minutes and postfixed with OsO4, were studied under the electron microscope. The protoplasm of growing half cells contains numerous organelles and vesicles, but no patterned arrangement of these cytoplasmic components in relation to the morphogenetic process leading to the characteristic shape ofMicrasteriascells could be observed.
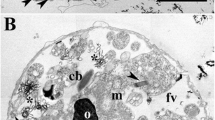
Two different kinds of vesicles are pinched off by cisternae of the dictyosomes,i.e. “large vesicles” (0.3–1.0μ, LV) with a content of low electron density and “dark vesicles” (800–2500 Å, DV) with a high contrast. It is assumed that L-vesicles possibly contain slime which is secreted through the pores of the secondary wall (Figs. 15–17), while D-vesicles contain cell wall material. Beside these two kinds of “Golgi-vesicles”, “coated vesicles” (CV) and “rod-containing vesicles” (SV) were found in the cytoplasm, the former often in a stage of fusion with the plasmalemma (Fig. 3).
Dictyosomes and cisternae of the “rough” ER are the most prominent cytoplasmic components of the growing half cell, while mitochondria and microbodies are present only in relatively small numbers. In very young developmental stages dictyosomes together with ER, mitochondria, and microtubules are clustered around the post-telophase nucleus, indicating a plasmatic stratification in these early developmental stages. However, in older stages when the nucleus migrates deeper into the growing half cell the organelles are distributed over the entire protoplasm.
Dictyosomes, showing a pronounced polar configuration,i.e. wide cisternae on one side (proximal pole) and narrow one on the other (distal pole), were found to be constantly associated at their proximal pole with a cisterna of the ER (Figs. 9, 10–12). Little vesicles were found between this ER-cisterna and the dictyosome (Figs. 10 and 11,VX), possibly playing a role in generating new Golgi-cisternae. While L- and D-vesicles are undoubtedly pinched off by cisterna of one and the same dictyosome (Fig. 11), no picture as yet could be obtained clarifying the origin of the “coated vesicles”. Budding of the membrane of D-vesicles may perhaps indicate a stage of formation of “coated vesicles” (Fig. 19).
In a few cases dictyosomes were found to be split into two halfs by a median break of the Golgi-cisternae (Figs. 10 and 11). The median splitting of the cisternae starts at the proximal pole and proceeds toward the distal pole. This phenomenon is interpreted as a “divisionstage” of a dictyosome.
In very young stages a stack of parallel ER-cisternae (ergastoplasm) was found in the vicinity of the nucleus (Fig. 20) while in later stages single cisternae, penetrating the whole cytoplasm of the half cell, dominate. The ergastoplasmic differentiation of the ER presumably indicates the high metabolic activity of these early postmitotic developmental stages. In non-growing half cells one ER-cisterna approaches the chloroplast-membrane thus forming a “periplastidial cisterna” (Fig. 21). Dictyosomes approach very closely this ER cisterna (Fig. 23).
Four distinct systems of microtubules could be found in growing cells (described in detail in a previous paper) but none of them exhibit a positional relationship to the symmetry and pattern of the growing half cell. For this reason and in agreement with previous osmotic studies it is speculated that the plasma-membrane itself maintains a specific pattern in its molecular structure that controls the deposition of wall-material. Although no further information or experimental support is available at present for such a pattern it is thought that perhaps vesicle-membranes in a manner of “intracellular membrane recognition” show special “affinities” to local areas of the plasma-membrane and discharge their content for the growing wall only at these loci. Such a mechanism could lead to a patterned growth of the primary wall in spite of a random distribution of organelles and vesicles and a very vigorous protoplasmic streaming.
Zusammenfassung
Wachsende, sich differenzierende Zellen vonMicrasterias denticulata Bréb. wurden 10 bis 15 Minuten mit Glutaraldehyd fixiert, mit OsO4 nachfixiert und elektronenmikroskopisch untersucht.
Das Protoplasma wachsender Halbzellen enthält zahlreiche Organellen und Vesikel, es konnte aber kein Anordnungsmuster dieser cytoplasmatischen Gebilde gefunden werden, das zu den morphogenetischen Prozessen, welche zur charakteristischen Form der Micrasterias-Zellen führen, eine Beziehung gezeigt hätte.
Zwei verschiedene Typen von Vesikeln werden von den Zisternen der Dictyosomen abgeschnürt: „large vesicles“ (0,3–1,0μ, LV) mit Inhalt von geringer Elektronendichte, und „dark vesicles” (800–2500 Å, DV) von starkem Kontrast. Wir nehmen an, daß L-Vesikel möglicherweise Schleim enthalten, der durch die Poren der Zellwand sezerniert wird (Abb. 15–17), während sich in den D-Vesikeln Zellwandmaterial befindet. Neben diesen zwei Typen von „Golgi-Vesikeln“ wurden im Cytoplasma „coated vesicles“ (CV) und „rod-containing vesicles“ (SV) gefunden, die erstgenannten oft während der Verschmelzung mit dem Plasmalemma (Abb. 3).
Dictyosomen und Zisternen des „rauhen“ ER sind die hervorstechenden Bestandteile des Cytoplasmas der wachsenden Halbzelle, während Mitochondrien und „Microbodies“ nur in relativ kleiner Zahl vorhanden sind. In sehr jungen Entwicklungsstadien ballen sich die
Dictyosomen, zusammen mit ER, Mitochondrien und Mikrotubuli, um den Posttelophase-Kern, was auf eine Plasmaschichtung in diesen frühen Entwicklungsstadien schließen läßt. In älteren Stadien, wenn der Nukleus tiefer in die wachsende Halbzelle wandert, sind die Organellen jedoch über das gesamte Protoplasma verteilt.
Die Dictyosomen, die ausgesprochen polaren Bau aufweisen, d. h. breite Zisternen an der einen Seite (proximaler Pol) und enge an der anderen (distaler Pol), sind nach unseren Beobachtungen stets an ihrem proximalen Pol einer Zisterne des ER angelagert (Abb. 9 und 10–12). Kleine Vesikel wurden zwischen dieser ER-Zisterne und dem Dictyosom gefunden (Abb. 10 und 11,VX). Sie spielen wahrscheinlich eine Rolle bei der Bildung neuer Golgi-Zisternen. “Während L- und D-Vesikel von Zisternen ein und desselben Dictyosoms abgeschnürt werden (Abb. 11), konnte bisher noch keine Aufnahme gemacht werden, die die Entstehung der „coated vesicles“ klären würde. Knospung der Membran von D-Vesikeln stellt vielleicht ein Stadium der Bildung von „coated vesicles“ dar (Abb. 19).
In einigen wenigen Fällen fanden sich Dictyosomen, die entlang einer Bruchstelle durch die Mitte der Golgi-Zisternen in zwei Hälften zerfielen (Abb. 10 und 11). Die Aufspaltung der Zisternen beginnt am proximalen Pol und schreitet gegen den distalen Pol fort. Diese Erscheinung wird als „Teilungsstadium“ eines Dictyosoms gedeutet.
In sehr jungen Entwicklungsstadien wurde ein Stapel paralleler ER-Zisternen (Ergastoplasma) in der Nähe des Kerns gefunden (Abb. 20); in späteren Stadien herrschen dagegen einzelne Zisternen vor, die das gesamte Cytoplasma der Halbzelle durchziehen. Die Differenzierung des ER zum Ergastoplasma zeigt vermutlich die hohe Stoffwechselaktivität dieser frühen postmitotischen Entwicklungsstadien an.
In alten Halbzellen ist eine ER-Zisterne der Chloroplastenhüllmembran angelagert und bildet eine „Periplastidärzisterne“ (Abb. 21). Dictyosomen nähern sich dieser ER-Zisterne auf sehr engem Abstand.
Vier deutlich verschiedene Systeme von Mikrotubuli konnten in wachsenden Zellen nachgewiesen werden und wurden in einer früheren Arbeit ausführlich beschrieben. Keines von ihnen zeigt jedoch eine Lagebeziehung zur Symmetrie oder zur Form der wachsenden Halbzelle. Deshalb und in Übereinstimmung mit früheren osmotischen Untersuchungen vermuten wir, daß die Plasmamembran selbst in ihrer Molekularstruktur ein spezifisches Muster enthält, das die Ablagerung von Zellwandmaterial kontrolliert. Obwohl gegenwärtig noch keine weiteren Einzelheiten und keine experimentellen Beweise für ein solches Muster zur Verfügung stehen, nehmen wir an, daß möglicherweise die Vesikel-Membranen in einer Art „intrazellulärer Membran-Erkennungsreaktion“ („membran-recognition“) besondere „Affinität“ zu lokalen Bezirken der Plasma-Membran aufweisen und ihren Inhalt nur an diesen Stellen an die wachsende Wand abgeben. Ein derartiger Mechanismus könnte trotz Zufallsverteilung der Organellen und Vesikel und sehr lebhafter Plasmaströmung zum Wachstum der Primärwand nach vorgegebenem Muster führen.
Similar content being viewed by others
Literatur
Afzelius, B. A., 1956: Electron microscopy of Golgi elements in sea urchin eggs. Exp. Cell Res.11, 67–85.
Amelunxen, F., undG. Gronau, 1966: Über die Polarität der Dictyosomen vonAcorus calamus L. Z. Pflanzenphysiol.55, 327–336.
Anton-Lamprecht, I., 1966: Elektronenmikroskopische Untersuchungen an Plasmonabänderungen von Epilobium-Bastarden. III. Über die Ausbildung eines ausgedehnten Ergastoplasmas in einer Plasmonabänderung mit Wachstumsstörungen. Ber. dtsch. bot. Ges.79, 324–328.
—, 1967: Elektronenmikroskopische Untersuchungen an Plasmonabänderungen vonEpilobium-Bastarden. I. Cytologische Untersuchungen zur Feinstruktur und Häufigkeit bisher unbekannter plasmatischer Partikeln in den Abänderungen der irregulare-Gruppe und einigen anderen Plasmatypen. Protoplasma64, 267–296.
Beams, H. W., andR. G. Kessel, 1968: The Golgi Apparatus: structure and function. Int. Rev. Cytol.23, 209–276.
Bielka, H., 1966: Struktur und Funktion des Ergastoplasmas. Biol. Rundschau4, 57–70.
Bonnett, H. T., andE. H. Newcomb, 1966: Coated vesicles and other cytoplasmic components of growing root hairs of radish. Protoplasma62, 59–75.
Bouck, G. B., 1965: Fine structure and organelle associations on brown algae. J. Cell Biol.26, 523–537.
Bowers, B., 1965: Coated vesicles in the pericardial cells of the aphid (Myzus persicae Sulz.). Protoplasma59, 351–367.
Bruni, C., andK. R. Porter, 1965: The fine structure of the parenchymal cell of the normal rat liver. I. General observations. Amer. J. Pathol.46, 691–756.
Buvat, R., 1958: Recherches sur les infrastructures du cytoplasme dans les cellules du méristème apical des ébauches foliaires et des feuilles développées d'Elodeacanadensis. Ann. soc. nat. Bot. Sér. XI,19, 121–161.
Caro, L. G., andG. E. Palade, 1964: Protein synthesis, storage and discharge in the pancreatic exocrine cell. J. Cell Biol.20, 473–493.
Chardard, R., etC. Rouiller, 1957: L'ultrastructure de trois Algues Desmidiées. Étude au microscope électronique. Rev. Cytol. et Biol. végét.18, 153–178.
Drawert, H., undM. Mix, 1961 a: Licht- und elektronenmikroskopische Untersuchungen an Desmidiaceen. IV. Mitt.: Beiträge zur elektronenmikroskopischen Struktur des Interphasekernes vonMicrasterias rotata. Z. Naturforsch.16 b, 546–551.
— —, 1961 b: Licht- und elektronenmikroskopische Untersuchungen an Desmidiaceen. VII. Mitt.: Der Golgi-Apparat vonMicrasterias rotata nach Fixierung mit Kalium- permanganat und Osmiumtetroxyd. Mikroskopie16, 207–212.
— —, 1961 c: Licht- und elektronenmikroskopische Untersuchungen an Desmidiaceen. VIII. Mitt.: Die Chondriosomen vonMicrasterias rotata. Flora151, 487–508.
— —, 1961 d: Licht- und elektronenmikroskopische Untersuchungen an Desmidiaceen. V. Mitt.: Über die Variabilität der Chloroplastenstruktur beiMicrasterias rotata. Planta56, 648–665.
— —, 1962 a: Zur Frage von Struktur und Funktion des „Golgi-Apparates“ in Pflanzenzellen. Sitzber. Ges. Beförd. ges. Naturwiss. Marburg83/84, 361–382.
— —, 1962 b: Zur Funktion des Golgi-Apparates in der Pflanzenzelle. Planta58, 448–452.
— —, 1962 c: Licht- und elektronenmikroskopische Untersuchungen an Desmidiaceen. X. Beiträge zur Kenntnis der „Häutung“ von Desmidiaceen. Arch. Mikrobiol.42, 96–109.
— —, 1963: Licht- und elektronenmikroskopische Untersuchungen an Desmidiaceen. XI. Mitt.: Die Struktur von Nucleolus und Golgi-Apparat beiMicrasterias denticulata Bréb. Portug. Acta Biol.VII, 17–28.
Falk, H., 1962: Zum Nucleolus-Feinbau beiAllium cepa. Protoplasma54, 432–439.
—, 1967: Zum Feinbau vonBotrydium granulatum Grev. (Xanthophyceae). Arch. f. Mikrobiol.58, 212–227.
Frederick, S. E., E. H. Nevcomb, E. L. Vigil, andW. P. Wergin, 1968: Fine-structural characterization of plant microbodies. Planta81, 229–252.
Frey-Wyssling, A., andK. Mühlethaler, 1965: Ultrastructural plant cytology. Amsterdam-London-New York: Elsevier Publ. Comp.
Gantt, E., andH. J. Arnott, 1965: Spore germination and development of the young gametophyte of the ostrich fern (Matteuccia struthiopteris). Amer. J. Bot.52, 82–94.
Gibbs, S. P., 1962: The uhrastructure of the chloroplasts of the algae. J. Ultrastruct. Res.7, 418–435.
Grassé, P. P., 1957: Ultrastructure, polarité et reproduction de l'appareil de Golgi. C. R. Acad. Sci. Paris245, 1278–1281.
Gray, E. G., 1961: The granule cells, mossy synapses and Purkinje spine synapses of the cerebellum: light and electron microscope observations. J. Anat.95, 345–356.
Hepler, P. K., andE. H. Newcomb, 1964: Microtubules and fibrils in the cytoplasm ofColeus cells undergoing secondary wall deposition. J. Cell Biol.20, 529–533.
Jarosch, R., 1962: Die Golgiapparate lebender Pflanzenzellen im Lichtmikroskop. Protoplasma55, 406–410.
—, undO. Kiermayer, 1962: Die Formdifferenzierung vonMicrasterias-Zelln nach lokaler Lichteinwirkung. Planta58, 95–112.
Kallio, P., 1951: The significance of nuclear quantity in the genusMicrasterias. Ann. bot. Soc. zool.-bot. fenn. „Vanamo“24, 1–22.
—, 1963: The effects of ultraviolett radiation and some chemicals on morphogenesis inMicrasterias. Suomal. Tiedeakat. A IV,70, 1–39.
Kiermayer, O., 1964: Untersuchungen über die Morphogenese und Zellwandbildung beiMicrasterias denticulata Bréb. Protoplasma59, 76–132.
- 1965:Micrasterias denticulata (Desmidiaceae) Morphogenese, Film Enc. Cinematogr. E 868/1965, Göttingen.
—, 1966: Septumbildung und Cytomorphogenese vonMicrasterias denticulata nach der Einwirkung von Äthanol. Planta71, 305–313.
Kiermayer, O., 1967 a: Das Septum-Initialmuster vonMicrasterias denticulata und seine Bildung. Protoplasma64, 481–484.
—, 1967 b: Dictyosomes inMicrasterias and their “division”. J. Cell Biol.35, 68 A.
—, 1968 a: The distribution of microtubules in differentiating cells ofMicrasterias dentkulata Bréb. Planta83, 223–236.
—, 1968 b: Hemmung der Kern- und Chloroplastenmigration vonMicrasterias durch Colchizin. Naturwiss.55, 299–300.
—, undR. Jarosch, 1962: Die Formbildung vonMicrasterias rotata Ralfs und ihre experimentelle Beeinflussung. Protoplasma54, 382–420.
Larson, D. A., 1965: Fine structural changes in the cytoplasm of germinating pollen. Amer. J. Bot.52, 139–154.
Leedale, G. F., B. J. D. Meeuse, andE. G. Pringsheim, 1965: Structure and physiology ofEuglena spirogyra I. II. Arch. Mikrobiol.50, 68–102.
Luft, J. H., 1961: Improvements in epoxy resin embedding methods. J. Biophys. Biochem. Cytol.9, 409–414.
Manton, I., 1964: Observations on the fine structure of the zoospore and young germling ofStigeoclonium. J. exp. Bot.15, 399–411.
Mix, M., 1966: Licht- und elektronenmikroskopische Untersuchungen an Desmidiaceen. XII. Zur Feinstruktur der Zellwände und Mikrofibrillen einiger Desmidiaceen vom Cosmarium-Typ. Arch. Mikrobiol.55, 116–133.
Mollenhauer, H. H., 1965: Transition forms of Golgi apparatus secretion vesicles. J. Ultrastruct. Res.12, 439–446.
—, andD. J. Morré, 1966: Golgi apparatus and plant secretion. Ann. Rev. Plant Physiol.17, 27–46.
—, andW. G. Whaley, 1963: An observation on the functioning of the Golgi apparatus. J. Cell Biol.17, 222–225.
Newcomb, E. H., 1969: Plant microtubules. Ann. Rev. Plant Physiol.20, 253–288.
Pickett-Heaps, J. D., 1967: The effects of colchicine on the ultrastructure of dividing plant cells, xylem wall differentiation and distribution of cytoplasmic microtubules. Develop. Biol.15, 206–236.
Porter, K. R., 1961: The ground substance: observations from electron microscopy. In: “The Cell” vol. II (eds.J. Brachet, andA. E. Mirsky), p. 621–675. New York: Academic Press.
—, 1966: Cytoplasmic microtubules and their function. In: Ciba Found. Symp. “Principles of Biomolecular Organization” (G. E. W. Wolstenholme, andM. O'Connor, eds.), p. 308–345. London: Churchill.
Reynolds, E. S., 1963: The use of lead citrate at high pH as an electron-opaque stain in electron microscopy. J. Cell Biol.17, 208–212.
Robards, A. W., 1968: On the ultrastructure of differentiating secondary xylem in Willow. Protoplasma65, 449–464.
Rosen, W. G., S. R. Gawlik, W. V. Dashek, andK. A. Siegesmund, 1964: Fine structure and cytochemistry ofLilium pollen tubes. Amer. J. Bot.51, 61–71.
Roth, T. F., andK. R. Porter, 1964: Yolk protein uptake in the oocyte of the mosquitoAedes aegypti L. J. Cell Biol.20, 313–332.
Schnepf, E., 1965 a: Die Morphologie der Sekretion in pflanzlichen Drüsen. Ber. dtsch. bot. Ges.78, 478–483.
—, 1965 b: Physiologie und Morphologie sekretorischer Pflanzenzellen. In:K. E. Wohlfarth-Bottermann (Hrsg.): Sekretion und Exkretion, 72–88. Berlin-Heidelberg-New York: Springer.
Selman, G. G., 1966: Experimental evidence for the nuclear control of differentiation inMicrasterias. J. Embryol. Exp. Morph.16, 469–485.
Sievers, A., 1963 a: Beteiligung des Golgi-Apparates bei der Bildung der Zellwand von Wurzelhaaren. Protoplasma56, 188–192.
—, 1963 b: Über die Feinstruktur des Plasmas wachsender Wurzelhaare. Z. Naturforsch.18 b, 830–836.
—, 1965: Elektronenmikroskopische Untersuchungen zur geotropischen Reaktion. I. Über Besonderheiten im Feinbau der Rhizoide vonChara foetida. Z. Pflanzenphysiol.53, 193–213.
—, 1967: Elektronenmikroskopische Untersuchungen zur geotropischen Reaktion. II. Die polare Organisation des normal wachsenden Rhizoids vonChara foetida. Protoplasma64, 225–253.
Sjöstrand, F. S., 1968: Ultrastructure and function of cellular membranes. In: The Membranes (Eds.A. J. Dalton, andF. Magenau). New York-London: Acad. Press.
Tilney, L. G., andK. R. Porter, 1967: Studies on microtubules inHeliozoa. II. The effect of low temperature on these structures in the formation and maintenance of the axopodia. J. Cell Biol.34, 327–343.
Waris, H., 1950: Cytophysiological studies onMicrasterias. I. Nuclear and cell division. Physiol. Plantarum3, 1–16.
—, andP. Kallio, 1964: Morphogenesis inMicrasterias. Advanc. Morphogenes.4, 45–80.
Weber, F., 1929: Plasmolyse-Ort. Protoplasma7, 583–601.
Whaley, W. G., 1966: Proposals concerning replication of the Golgi apparatus. In:P. Sitte: Probleme der biologischen Reduplikation. 3. Konf. Ges. dtsch. Natf. u. Ärzte, Semmering b. Wien. Berlin-Heidelberg-New York: Springer.
Author information
Authors and Affiliations
Additional information
This work was supported by a National Science Foundation Senior Foreign Scientist Fellowship to Dr. Oswald Kiermayer, and by funds of Training Grant 5-M 1-GM-707-06 to Dr. Keith R. Porter.
I am most grateful to Drs.Keith R.Porter andPeter K.Hepler (Harvard University) for numerous discussions and guidance in this investigation and also Mrs. Pamela Pettengill for her technical help.
Rights and permissions
About this article
Cite this article
Kiermayer, O. Elektronenmikroskopische Untersuchungen zum Problem der Cytomorphogenese vonMicrasterias denticulata Bréb. Protoplasma 69, 97–132 (1970). https://doi.org/10.1007/BF01276654
Received:
Issue Date:
DOI: https://doi.org/10.1007/BF01276654