Summary
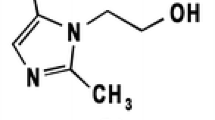
A procedure for the quantitative determination of penicillic acid in foods of plant origin (peas, rice, oatmeal, and coconut flakes) is described. For extraction a 1 + 1 mixture of dichlormethane and methanol is used. The final separation of penicillic acid is carried out by two-dimensional thinlayer chromatography. Penicillic acid is (in situ) converted into a strongly fluorescent derivative (maximal emission at 440–445 nm by excitation at 365–370 nm) by reaction with diphenylboric acid-2-aminoethylester during an immersion procedure. The intensity of fluorescence is linearly proportional to the amount of penicillic acid within the concentration range from about 50 to 600 ng per spot. The recovery rate is about 95%. The lower limit for the semiquantitative detection of penicillic acid is about 5 ng per spot.
Zusammenfassung
Es wird ein Verfahren zur quantitativen Bestimmung der Penicillinsäure in pflanzlichen Lebensmitteln (Erbsen, Reis, Haferflocken und Kokosraspeln) angegeben. Als Extraktionsmittel wird ein Gemisch von Dichlormethan/Methanol (1 + 1) benutzt. Die terminale Abtrennung der Penicillinsäure erfolgt durch zweidimensionale Dünnschichtchromatographie. Durch Umsetzung mit Diphenylborsäure-2-ethanolamin in einem Tauchverfahren wird die Penicillinsäure auf der Platte in ein stark fluorescierendes Derivat verwandelt (maximale Emission bei 440–445 nm nach Anregung bei 365–370 nm).
Die Fluorescenzintensität ist der Menge an Penicillinsäure im Bereich von ca. 50–600 ng pro Fleck direkt proportional. Die Wiederfindungsraten liegen bei etwa 95%. Die untere Grenze für den semiquantitativen Nachweis der Penicillinsäure liegt bei etwa 5 ng pro Fleck.
Similar content being viewed by others
Literatur
Alsberg CL, Black OF (1913) US Dept Agric Bull Bur Plant Ind 270:7
Ciegler A, Detroy RW, Lillehoj EB (1971) Penicillic Acid. In: Microbial Toxins, Vol. VI, pp 414–420, Ciegler A, Kadis S, Ail SJ (eds) Academic Press, New York London
Olivigni FJ, Bullerman LB (1978) A microbial assay for penicillic acid. J Food Prot 41:432
Wyllie TD, Moorehouse LG (1978) Mycotoxic Fungi, Mycotoxins, Mycotoxicoses. Vol. 1, pp 311–316, Marcel Dekker Inc., New York Basel
Lieu FY, Bullerman LB (1978) Binding of patulin and penicillic acid to glutathione and cysteine and toxicity of the resulting adducts. Milchwissenschaft 33:16
Bentley R, Keil JG (1962) Tetronic acid biosynthesis in molds. Formation of penicillic acid in Penicillium cyclopium. J Biol Chem 237:867
Jones JB, Young JM (1966) Carcinogenicity of lactones. 1. The reaction of 4-methylbuteno- and 4-methylbutano-lactones with primary amines. Can J Chem 44:1059
Stoloff L, Nesheim S, Yin L, Rodricks JV, Stack M, Campbell AD (1971) A multitoxin detection method for aflatoxins, ochratoxins, zearalenone, sterigmatocystin and patulin. J Assoc Off Anal Chem 54:91
Ciegler A, Kurtzmann CP (1970) Penicillic acid production by blue-eye fungi on various agricultural commodities. Appl Microbiol 20:761
Bullerman LB (1978) Methods for detecting mycotoxins in food and beverages. In: Food Beverage Mycology, pp 445–470, Avi, Westport, Conn
Brown RF (1968) The effect of some mycotoxins on the brineshrimp Artemia salina. J Am Oil Chem Soc 46:119
Sternberg M (1956) Studii Cercetani Chim 4:315
Ciegler A, Kurtzmann CP (1970) Fluorodensitometric assay of penicillic acid. J Chromatogr 31:511
Ciegler A, Mintzlaff HJ, Weisleder D, Leistner L (1972) Potential production and detoxification of penicillic acid in mold-fermented sausage (Salami). Appl Microbiol 24:114
Durackova Z, Betina V, Nemec P (1976) Systematic analysis of mycotoxins by TLC. J Chromatogr 116:141
Scott PM, Lawrence JW, van Walbeek W (1970) Detection of mycotoxins by thin-layer chromatography: Application to screening of fungal extracts. Appl Microbiol 20:839
Tauchmann F, Toth L, Leistner L (1971) Halbquantitative Bestimmung von Patulin in Fleisch und Fleischwaren. Fleischwirischaft 7:1079
Meyer RA (1977) Chlor-Benzidin als dünnschichtchromatographisches Nachweisreagenz für Patulin in Apfelsaft. Nahrung 21:85
Steyn PS, Gorst-Allman CP (1979) Screening method for detection of thirteen common mycotoxins. J Chromatogr 175:325
Scott PM (1974) Patulin. In: Mycotoxins, Purchase IFH (ed) p 383. Elsevier Scientific Publishing Company. Amsterdam Oxford New York
Meyer RA (1976) Chlor-Tolidin und Chlor-Dianisidin als dünnschichtchromatographische Detektionsreagenzien für Patulin. Nahrung 20:79
Author information
Authors and Affiliations
Additional information
Diese Arbeit wurde vom Bundesministerium für Jugend, Familie und Gesundheit gefördert.
Rights and permissions
About this article
Cite this article
Ehnert, M., Popken, A.M. & Dose, K. Quantitative Bestimmung der Penicillinsäure in pflanzlichen Lebensmitteln. Z Lebensm Unters Forch 172, 110–114 (1981). https://doi.org/10.1007/BF01042415
Received:
Issue Date:
DOI: https://doi.org/10.1007/BF01042415