Summary
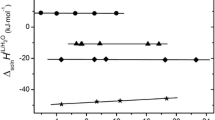
The vibrational spectra of solutions have been analyzed to assess both qualitatively and quantitatively the changes in enthalpy and entropy for ion pair formation in solutions of LiNCS, Mg(NCS)2, and LiN3 in liquid ammonia, dimethylformamide, dimethylsulphoxide and acetonitrile. Contrary to predictions both the ΔH ass and ΔS ass terms are all positive in the cases examined, indicating that the driving force in the ion association process derives from solvent-solute restructuring, and not the energy of the interaction between the cation and anion. This characteristic of contact ion pair formation is likely to be found to be applicable over a wide range of solvents. The following specific values of the thermodynamic parameters at 298 K have been obtained: LiNCS/DMF, ΔG=−1.3 (1) kJ mol−1, ΔH ass =+1.8 (5) kJ mol−, ΔS ass =+10 (2) J mol−1 K−1; LiNCS/DMSO, ΔG=+0.9 (2) kJ mol−1, ΔH ass =+0.3 (3) kJ mol−1; Mg(NCS)2/DMF, ΔG ass =−4.0 (3) kJ mol−1, ΔH ass =+15 (4) kJ mol−1, ΔS=+64 (17) kJ mol−1; LiN3/DMSO, ΔG ass =−2.5 (3) kJ mol−1, ΔH ass =+4.9 (9) kJ mol−1, ΔS ass =∼+25 (10) J K−1 mol−1.
Zusammenfassung
Um die Enthalpie- und Entropieänderungen bei der Bildung von Kontaktionenpaaren sowohl quantitativ als auch qualitativ zu bestimmen wurden Schwingungspektren von Lösungen von LiNCS, Mg(NCS)2 and LiN3 in flüssigem Ammoniak, Dimethylformamid, Dimethylsulphoxid and Acetonitril untersucht. Im Gegensatz zu Vorhersagen sind die Enthalpie- und Entropie in allen untersuchten Fällen positiv. Diese Tatsache deutet daraufhin, daß die treibende Kraft des Assoziationsprozesses die Umstrukturierung der Lösung und nicht die Wechselwirkungsenergie zwischen Kation und Anion ist. Diese Eigenschaft der Kontaktionenpaarbildung ist wahrscheinlich auf eine große Anzahl von Lösungsmitteln übertragbar. Folgende, spezifische Werte wurden für die thermodynamischen Parameter ermittelt: LiNCS/DMF, ΔG=−1.3 (1)kJmol−1, ΔH ass =+1.8 (5)kJmol−1, ΔS ass =+10 (2)Jmol−1K−1; LiNCS/DMSO, ΔG=+0.9 (2)kJmol−1, ΔH ass =+0.3 (3)kJmol−1; Mg (NCS)2/DMF, ΔG ass =−4.0 (3)kJmol−1, ΔH ass =+15 (4)kJmol−1, ΔS=+64 (17)kJmol−1; LiN3/DMSO, ΔG ass =−2.5 (3)kJmol−1, ΔH ass =+4.9 (9)kJmol−1, ΔS ass =∼+25 (10)JK−1mol−1.
Similar content being viewed by others
References
Chingakule D. D. K., Gans P., Gill J. B. (1991) J. Chem. Soc. Dalton Trans.: 1329
Gill J. B. (1981) Pure Appl. Chem.53: 1365
Gill J. D. (1987) Pure Appl. Chem.66: 1127
Irish D. E., Davis A. R., Plane R. A. (1969) J. Phys. Chem.50: 2262
Sze Y.-K., Irish D. E. (1981) J. Solution Chem.7: 395
Sze Y.-K., Irish D. E. (1982) J. Solution Chem.8: 395
Riddell J. D., Lockwood D. J., Irish D. E. (1972) Canadian J. Chem.50: 2951
Irish D. E., Tang S.-Y., Talts H., Petrucci S. (1979) J. Phys. Chem.83: 3268
Chabanel M. (1990) Pure Appl. Chem.62: 35
Loupy A., Corset J. (1974) Comptes Rendus273C: 713
Loupy A., Corset J. (1976) J. Solution Chem.5: 817
Regis A., Corset J. (1975) Chem. Phys. Lett.32: 462
Bacelon P., Corset J., de Loze C. (1980) J. Solution Chem.9: 129; (1983)12: 1
Hnizda V., Kraus C. A. (1949) J. Am. Chem. Soc.71: 476
Kay R. L. (1960) J. Am. Chem. Soc.82: 2099
Gill J. B., Lowe B. M. (1972) J. Chem. Soc., Dalton Trans.: 1959
Janz G., Müller M. H. (1985) J. Solution Chem.4: 85
Yeager H. L., Kratochvil B. (1969) J. Phys. Chem.73: 1363
Longdon P. J. (1990) Ph.D. Thesis, University of Leeds
Gans P., Gill J. B., Longdon P. J. (1989) J. Chem. Soc. Far. Trans. I.85: 1835
Chabanel M., Bencheikh A., Puchalska B. (1989) J. Chem. Soc. Dalton Trans.: 2193
Gutmann V., Wychera E. (1966) Inorg. Nucl. Chem. Letters2: 257
Mayer U., Gutmann V., Gerger W. (1975) Monatsh. Chemie106: 1235
Paoli D. (1982) Thèse d'Etat, Nantes
Rannou J., Chabanel M. (1980) J. Chim. phys.77: 201
Chabanel M., Lucon M., Paoli D. (1981) J. Phys. Chem.85: 1058
Kim Y. H., Paoli D., Chabanel M. (1985) Comptes Rendus301 C: 1113
Chabanel M., Wang Z. (1984) J. Phys. Chem.88: 1441
Goralski P., Chabanel M. (1987) Inorg. Chem.26: 2169
Cheek Y., Gans P., Gill J. B., Reyner C. (1986) Spectrochimica Acta42 A: 1349
Gans P., Gill J. B., Johnson L. H. (1987) J. Chem. Soc., Dalton Trans.: 673
Gans P., Gill J. B., Goddall D. C., Jeffries B. (1986) J. Chem. Soc., Dalton Trans.: 2597
Gans P., Gill J. B. (1977) Appl. Spectrosc.31: 451
Gans P., Gill J. B. (1983) Appl. Spectrosc.37: 370; 515
Chingakule D. D. K. (1990) Ph.D. Thesis, Leeds
Vaes J., Chabanel M., Martin M. L. (1978) J. Phys. Chem.82: 2420
Inoue N., Xu M., Petrucci S. (1987) J. Phys. Chem.91: 4628
Earl G. J. (1980) Ph.D. Thesis, Leeds
Irish D. E., Chang T. G., Tang S.-Y. (1981) J. Phys. Chem.85: 1686
Hinton J. F. (1987) Magn. Reson. Chem.25: 659
Metz K. R., Hinton J. F. (1980) J. Solution Chem.9: 197
Metz K. R., Hinton J. F. (1981) J. Solution Chem.10: 21
Baldwin J., Gill J. B. (1970) Phys. and Chem. of Solutions2: 25
Gardiner D. J., Haji A. H., Straughan B. P. (1976) J. Chem. Soc., Faraday I72: 93
Author information
Authors and Affiliations
Additional information
Submitted to celebrate the 70th Birthday of Professor Viktor Gutmann, and in recognition of his considerable contributions towards the better understanding of Chemistry in the Solution Phase
Rights and permissions
About this article
Cite this article
Chingakule, D.D.K., Gans, P., Gill, J.B. et al. Spectrochemistry of solutions, part 23. Changes of enthalpy and entropy in the formation of contact ion pairs: A vibrational spectroscopic appraisal using thiocyanate and azide solutions. Monatsh Chem 123, 521–535 (1992). https://doi.org/10.1007/BF00816846
Received:
Accepted:
Issue Date:
DOI: https://doi.org/10.1007/BF00816846