Summary
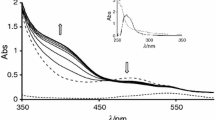
The composition and stability of the following biogenic amine complexes have been investigated: 1,4-diaminobutane(Put), 4-azaoctane-1,8-diamine(Spd), 4,9-diazadodecan-1, 12-diamine(Spm) as well as homologues such as 1,3-diaminopropane(Put3), 4-azaheptane-1, 7-diamine(Spd3,3) and 4,8-diazaundecan-1,11-diamine(Spm3,3,3) with H+, Cu(II), Zn(II), Pb(II) and Mg(II). A potentiometric method was used. The VIS technique enabled the determination of coordination mode in copper/amine systems. It was found that Mg(II) does not form coordination compounds with any of the studied polyamines in solution. An increase in the concentration of ligand and metal was found to result in a stronger tendency towards the formation of protonated compounds accompanied by a decrease in the concentration of hydroxocomplexes. At physiologicalpH (7.4) an increase in the concentration of protonated compounds by approximately 15% was observed within the ligand concentration range from 0.001 mol dm−3 to 0.0001 mol dm−3 at a Cu(II) concentration of 0.000177 mol dm−3.
Zusammenfassung
Anhand einer Analyse von potentiometrischen Daten wurden Zusammensetzung und Beständigkeit folgender biogener Aminkomplexe untersucht: 1,4-Diaminobutan(Put), 4-Azaoktan-1,8-diamin(Spd), 4,9-Diazadodekan-1,12-diamin(Spm), sowie auch deren Homologen 1,3-Diaminopropan(Put3), 4-Azaheptan-1,7-diamin(Spd3,3) und 4,8-Diazaundekan-1,11-diamin(Spm3,3,3) mit H+, Cu(II), Zn(II), Pb(II) und Mg(II). Mit Hilfe der VIS-Technik wurde die Koordinationsweise in Kupfer/Amin-Systemen bestimmt. Es wurde festgestellt, daß Mg(II) keine Koordinationsverbindungen mit den untersuchten Polyaminen bildet. Eine höhere Konzentration von Ligand und Metall führte zu stärkerer Tendenz der Bildung protonierter Verbindungen, wobei die Konzentration von Hydroxokomplexen kleiner wurde. Bei physiologischempH (7.4) wurde im Bereich der Ligand-Konzentration von 0.001 mol dm−3 bis 0.0001 mol dm−3 bei einer Cu(II)-Konzentration von 0.000177 mol dm−3 ein Anstieg der Konzentration protonierter Verbindungen um etwa 15% beobachtet.
Similar content being viewed by others
References
Tabor C. W., Tabor H. (1984) Ann. Rev. Biochem.53: 749
Kimberley N. M., Goldstein J. H. (1981) Anal. Chem.53: 789
Anichini A., Fabrizzi L., Barbucci R., Mastroianni A. (1977) J. Chem. Soc. Dalton: 2224
Porter C. W., Bergeron R. J. (1983) Science219: 1083
Porter C. W., Cavanaugh Jr. P. F., Stolwich N., Ganis B., Kelly E., Bergeron R. J. (1985) Cancer Res.45: 2050
Templeton D. M., Sarkar B. (1985) Can. J. Chem.63: 3112
Vertino P. M., Bergeron R. J., Cavanaugh Jr. P. F., Porter C. W. (1987) Biopolymers26: 691
Burton R., Forsen S., Reimarsson P. (1981) Nucl. Acid Res.9: 1219
Nothig-Laslo V., Weygand-Durasevic J., Zivkovic T., Kucan Z. (1981) Eur. J. Biochem.117: 263
Gosule L. G., Schellman J. A. (1978) J. Mol. Biol.121: 311
McMahon H. E., Erdmann V. A. (1982) Biochemistry21: 5280
Saenger W. (1984) Principles of Nucleic Acid Structure. Springer, Berlin Heidelberg New York Tokyo
Palmer B. N., Powell H. K. J. (1974) J. Chem. Soc. Dalton: 2086
Palmer B. N., Powell H. K. J. (1974) J. Chem. Soc. Dalton: 2089
Paoletti P., Nuzzi F., Vacca A. (1966) J. Chem. Soc. (A): 1385
Bertsch G. R., Fernelius W. C., Block B. P. (1958) J. Phys. Chem.62: 444
Antonelli M. L., Balzamo S., Carunchio V., Cernia E., Purrello P. (1988) J. Inorg. Biochem.32: 153
Pfeifer P. (1948) Naturwiss.35: 190
Lomozik L. (1984) Monatsh. Chem.115: 261
Irving H. M., Miles M. G., Pettit L. D. (1967) Anal. Chim. Acta38: 475
Sayce J. G. (1968) Talanta15: 1387
Sabatini A., Vacca A., Gans P. (1974) Talanta21: 53
Ingri N., Kakolowicz W., Sillen L. G., Warnquist B. (1967) Talanta14: 1261
Sillen L. G., Martell A. E. (1971) Stability Constants of Metal-Ion Complexes. The Chemical Society, London
Purcell K. F., Kotz J. C. (1977) Inorganic Chemistry. Saunders, Philadelphia
Lomozik L., Wojciechowska A. (1989) Polyhedron22: 2645
Boggs R., Donohue J. (1975) Acta Crystallogr.B31: 320
Author information
Authors and Affiliations
Rights and permissions
About this article
Cite this article
Wojciechowska, A., Bolewski, L. & Lomozik, L. A study of polyamine complex formation with H+, Cu(II), Zn(II), Pb(II), and Mg(II) in aqueous solution. Monatsh Chem 122, 131–138 (1991). https://doi.org/10.1007/BF00809357
Received:
Accepted:
Issue Date:
DOI: https://doi.org/10.1007/BF00809357