Abstract
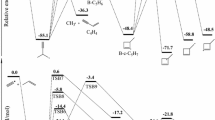
A model for the reaction CH .3 +CH2=CH2 is studied including the hybridization change of the reaction center. The interaction energy is devided into two parts. The first is a stabilization energy — the contribution due to the π-electron delocalization (including the hybridization effects). It is computed by the PPP method. The second part is an exchange repulsion due to all valence electrons of the three carbon atoms. Correlation corrections are considered. A potential energy surface is constructed, giving a saddle point value close to the experimental activation energy. A discussion is given of the approximations involved. The method suggested is a generalization of the reactivity indices method of the theory of chemical reactivity. It can be regarded as a justification of this more empirical approach.
Zusammenfassung
Ein Modell für die Reaktion CH .3 +CH2=CH2 wird untersucht, einschließlich der Änderung der Hybridisation des Reaktionszentrums. Die Wechselwirkungsenergie wird in zwei Teile zerlegt. Der erste Teil ist eine Stabilisationsenergie — der Beitrag, der der Delokalisierung des π-Elektrons (einschließlich Hybridisationseffekte) entspricht. Der zweite Teil ist eine Austauschabstoßung, die von allen Valenzelektronen der drei Kohlenstoffatome herrührt. Korrellationskorrekturen werden berücksichtigt. Eine Fläche der potentiellen Energie wird konstruiert mit einem Sattelpunktswert, der dicht an der experimentellen Aktivierungsenergie liegt. Die verwendeten Näherungsmethoden werden diskutiert. Die vorgeführte Methode ist eine Verallgemeinerung der Methode der Reaktivitätsindices aus der Theorie der chemischen Reaktivität. Sie kann als eine Rechtfertigung dieser mehr empirischen Näherung angesehen werden.
Résumé
Etude d'un modèle pour la réaction CH .3 +CH2=CH2 où l'on tient compte du changement d'hybridation du centre réactif. L'énergie d'interaction est divisée en deux termes. Le premier est une énergie de stabilisation; c'est la contribution dela délocalisation des électrons π (effets d'hybridation compris). Il est calculé par la méthode PPP. Le second terme est une répulsion d'échange dûe à tous les électrons de valence des trois atomes de carbone. Les corrections de corrélation sont introduites.
Une surface d'énergie potentielle est construite; elle fournit une valeur de l'énergie d'activation proche de celle obtenue expérimentalement. Les approximations utilisées sont discutées. La méthode proposée est une généralisation de celles des indices de réactivité. On peut la considérer comme justifiant cette approche plus empirique.
Similar content being viewed by others
References
Evans, M., J. Gegerly, and E. Seaman: J. Polym. Sci. 3, 866 (1948).
Bagdasaryan, Kh. S.: Zh. Fiz. Khim. 23, 1375 (1949). (in Russian).
Fukui, K.: Molecular orbitals in chemistry, physics and biology. Acad. Press 1964.
Basilevsky, M. V.: Radiospectroscopic and quantum chemical methods in structural research, pp. 40, 50. Moscow: Nauka 1967 (in Russian).
—: Dokl. Acad. Nauk SSSR 172, 1405 (1967). (in Russian).
—: Theoret. chim. Acta (Berl.) 13, 409 (1969).
Roothaan, C. C. J.: Rev. modern. Physics 32, 179 (1960).
Hoyland, J. R., and L. Goodman: J. chem. Physics 36, 12 (1962).
Dewar, M. J. S., and H. N. Schmeising: Tetrahedron 11, 96 (1960).
Chung, A. L. H., and M. J. S. Dewar: J. chem. Physics 42, 756 (1965).
Lorquet, A. J.: Theoret. chim. Acta (Berl.) 5, 192 (1966).
Hogg, A. M., and P. Kebarle: J. Amer. chem. Soc. 86, 4558 (1964).
Brinton, R. K.: J. chem. Physics 29, 781 (1958).
Mandelcorn, L., and E. W. R. Steacie: Canad. J. Chem. 32, 474 (1954).
Landers, L. C., and D. H. Volman: J. Amer. chem. Soc. 79, 2996 (1957).
Endrenyi, L., and D. J. Le Roy: J. physic. Chem. 71, 1334 (1967).
Ainbinder, B. Yu., and M. V. Basilevsky: Zh. Strukt. Khim. 9, 513 (1968). (in Russian).
Author information
Authors and Affiliations
Rights and permissions
About this article
Cite this article
Basilevsky, M.V., Chlenov, I.E. A semi-empirical calculation of the potential surface for the CH .3 +CH2=CH2 reaction. Theoret. Chim. Acta 15, 174–180 (1969). https://doi.org/10.1007/BF00528253
Received:
Issue Date:
DOI: https://doi.org/10.1007/BF00528253