Summary
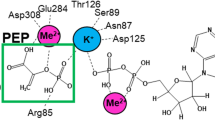
This study is concerned with the regulation of pyruvate kinase (ATP: pyruvate phosphotransferase, EC 2.7.1.40) of the photosynthetic bacterium Rhodospirillum rubrum. Cellular activity levels of the enzyme are not influenced by the culture conditions. Electrophoretic separation of proteins in cell free extracts yields one activity band only. A procedure is described for reproducible 100-fold purification of the enzyme up to specific activities of 30–40 μmoles/min·mg protein. The molecular weight of the enzyme as estimated by gelfiltration is 250 000. Enzyme activity is dependent on the presence of a divalent metal ion (Mg2+), but independent of the presence of a monovalent kation like K+ or NH4 +. Glucose-6-phosphate (G-6-P), ribose-5-phosphate (R-5-P), fructose-6-phosphate (F-6-P), and to a lesser extent, fructose-1,6-bisphosphate are activators, adenosintriphosphate (ATP) and inorganic phosphate (P i ) are inhibitors of the enzyme. Increase of reaction velocity with increasing phosphoenolpyruvate (PEP) concentration follows a sigmoidal saturation curve with Hill coefficients n H of 2 (pH 6) or 2.8 (pH 8). PEP concentrations at which half maximal reaction rates are attained (S 0.5-values) are 0.06 (pH 6) or 0.14 (pH 8) mM, respectively. The ADP-saturation curve is hyperbolic with a K m of 0.1 mM. The activators G-6-P, R-5-P, and F-6-P eliminate the cooperativity of the PEP-saturation curve (i.e. n H=1) and decrease the S 0.5-value of PEP from 0.12 to 0.02 mM (pH 7.2). As an allosteric inhibitor (K i&0.05 mM), P i increases the cooperativity of the PEP-saturation curve (n H=3 in the presence of 1 mM P i compared to n H=2.1 in the absence of any effector) and shifts the S 0.5-value of PEP to higher concentrations. On the other hand, inhibition of the enzyme by ATP is competitive with respect to PEP (K i=0.2 mM). Excellent fit of the experimental kinetic data to the theoretical saturation function according to the symmetry model of allosteric enzymes (Monod et al., 1965) is obtained with n=3 as the number of interacting sites and L=200 as the allosteric constant.
Zusammenfassung
Die vorliegende Arbeit befaßt sich mit der Regulation der Pyruvatkinase (ATP: Pyruvat-Phosphotransferase, EC 2.7.1.40) in dem phototrophen Bakterium Rhodospirillum rubrum. Die spezifische Aktivität der Pyruvat-kinase in zellfreien Extrakten ist unabhängig von den Bedingungen der Zellanzucht. Nach elektrophoretischer Auftrennung der Extraktproteine wird stets nur eine enzymatisch aktive Bande erfaßt. Es wird ein Verfahren zur reproduzierbaren 100fachen Anreicherung des Enzyms bis zu einer spezifischen Aktivität von 30 bis 40 μmole/min·mg Protein beschrieben. Das Molekulargewicht (Bestimmung durch Gelfiltration) der Pyruvatkinase beträgt 250 000. Die Enzymaktivität ist abhängig von zweiwertigen Metallionen (Mg2+), aber unabhängig von monovalenten Kationen wie K+ oder NH4 +. Glucose-6-phosphat (G-6-P), Ribose-5-phosphat (R-5-P), Fructose-6-phosphat (F-6-P) und — wesentlich schwächer wirksam — Fructose-1,6-bisphosphat sind Aktivatoren, Adenosintriphosphat (ATP) und anorganisches Phosphat (P a ) sind Inhibitoren des Enzyms. Der Anstieg der Reaktionsgeschwindigkeit mit steigender Phosphoenolpyruvat (PEP)-Konzentration folgt einer sigmoiden Sättigungsfunktion mit einem Hill-Koeffizienten n H von 2 (pH 6) bzw. 2,8 (pH 8). Die PEP-Konzentrationen, bei denen halbmaximale Reaktionsraten erzielt werden (S 0.5-Werte), sind 0,06 (pH 6) bzw. 0,14 (pH 8) mM. Die ADP-Sättigungskurve ist hyperbolisch mit einem K m von 0,1 mM. Die Aktivatoren G-6-P, R-5-P und F-6-P heben die Kooperativität der PEP-Sättigungskurve auf (d.h. n H=1) und erniedrigen den S 0.5-Wert für PEP von 0,12 auf 0,02 mM (pH 7,2). Als allosterischer Inhibitor (geringster experimentell ermittelter K i ist 0,05 mM) erhöht P a die Kooperativität der PEP-Sättigungskurve (n H=3 in Gegenwart von 1 mM P a verglichen mit n H=2,1 in Abwesenheit eines Effektors) und verschiebt den S 0.5-Wert für PEP in Richtung höherer Konzentrationen. Die Hemmung des Enzyms durch ATP ist demgegenüber kompetitiv in bezug auf PEP mit einem K i von 0,2 mM. Übereinstimmung der experimentell ermittelten PEP-Sättigungskurve mit der vom Symmetriemodell allosterischer Enzyme (Monod et al., 1965) geforderten theoretischen Sättigungsfunktion ergibt sich mit einer Anzahl der PEP-bindenden Untereinheiten von n=3 und einer allosterischen Konstante von L=200.
Similar content being viewed by others
Abbreviations
- A:
-
Extinktion
- EDTA:
-
Athylendiamintetraacetat
- FDP:
-
Fructose-1,6-bisphosphat
- F-6-P:
-
Fructose-6-phosphat
- G-6-P:
-
Glucose-6-phosphat
- GDH:
-
Glycerin-3-phosphat-Dehydrogenase
- GDP:
-
Guanosindiphosphat
- GSH:
-
Glutathion, reduziert
- LDH:
-
Lactatdehydrogenase
- MDH:
-
Malat-dehydrogenase
- NADH:
-
reduziertes Nicotinamid-Adenin-Dinucleotid
- P a :
-
anorganisches Phosphat
- PEP:
-
Phosphoenolpyruvat
- R-5-P:
-
Ribose-5-phosphat
- TIM:
-
Triosephosphat-Isomerase
Literatur
Barwell, C. J., Woodward, B., Brunt, R. V.: Regulation of pyruvate kinase by fructose-1,6-diphosphate in Saccharomyces cerevisiae. Europ J. Biochem. 18, 59–64 (1971).
Beisenherz, G., Boltze, H.-J., Bücher, T., Czok, R., Garbade, K.-H., Meyer-Arendt, E., Pfleiderer, G.: Diphosphofructose-Aldolase, Phosphoglycerin-aldehyd-Dehydrogenase, Milchsäure-Dehydrogenase- Glycerinphosphat-Dehydrogenase und Pyruvat-Kinase aus Kaninchenmuskulatur in einem Arbeitsgang. Z. Naturforsch. 8b, 555–577 (1953).
Blair, J. McD.: Magnesium, potassium, and the adenylate kinase equilibrium. Magnesium as a feedback signal from the adenine nucleotide pool. Europ. J. Biochem. 13, 384–390 (1970).
Cooper, R. A., Kornberg, H. L.: Phosphoenolpyruvate synthetase. In: S. P. Colowick und N. O. Kaplan, Hrsg., Methods in enzymology, Vol. XIII, pp. 309–314. New York: Academic Press 1969.
Cornish, A. S., Johnson, E. J.: Regulation of pyruvate kinase from Thiobacillus neopolitanus. Arch. Biochem. Biophys. 142, 584–591 (1971).
Davis, B. J.: Disc electrophoresis. II. Method and application to human serum proteins. Ann. N. Y. Acad. Sci. 121, 404–427 (1964).
Diesterhaft, M., Freese, E.: Pyruvate kinase of Bacillus subtilis. Biochim. biophys. Acta (Amst.) 268, 373–380 (1972).
Hess, B., Haeckel, R., Brand, K.: FDP-activation of yeast pyruvate kinase. Biochem. Biophys. Res. Commun. 24, 824–831 (1966).
Ide, M.: Pyruvate kinase of Brevibacterium liquefaciens. Arch. Biochem. Biophys. 140, 408–414 (1970).
Kapoor, M., Tronsgaard, T. M.: Pyruvate kinase of Neurospora crassa: purification and some properties. Canad. J. Microbiol. 18, 805–815 (1972).
Klemme, J.-H.: Allosterisch regulierte und nicht-regulierte Pyrophosphat-Phosphohydrolasen aus phototrophen Bakterien. Habilitationsschrift, Universität Göttingen 1972.
Klemme, J.-H., Gest, H.: Regulation of the cytoplasmic inorganic pyrophosphatase of Rhodospirillum rubrum. Europ. J. Biochem. 22, 529–537 (1971).
Liao, C.-L., Atkinson, D. E.: Regulation at the phosphoenolpyruvate branchpoint in Azotobacter vinelandii: Pyruvate kinase. J. Bact. 106, 37–44 (1971).
Maeba, P., Sanwal, B. D.: The regulation of pyruvate kinase of Escherichia coli by fructose diphosphate and adenylic acid. J. biol. Chem. 243, 448–449 (1968).
Malcovati, M., Kornberg, H. L.: Two types of pyruvate kinase in Escherichia coli K 12. Biochim. biophys. Acta (Amst.) 178, 420–423 (1969).
Monod, J., Wyman, J., Changeux, J. P.: On the nature of allosteric transitions. J. molec. Biol. 12, 88–118 (1965).
Ohmann, E.: Die Regulation der Pyruvat-Kinase in Euglena gracilis. Arch. Mikrobiol. 67, 273–292 (1969).
Ormerod, J. G., Ormerod, K. S., Gest, H.: Light-dependent utilization of organic compounds and photoproduction of molecular hydrogen by photosynthetic bacteria, relationships with nitrogen metabolism. Arch. Biochem. Biophys. 94, 449–463 (1961).
Sols, A., Marco, R.: Concentrations of metabolites and binding sites. Implications in metabolic regulation. In: B. L. Horecker und E. R. Stadtman, Hrsg., Current topics in cellular regulation, Vol. 2, pp 227–273. New York: Academic Press 1970.
Tuominen, F. W., Bernlohr, R. W.: Pyruvate kinase of the spore-forming bacterium, Bacillus licheniformis. I. Purification, stability, regulation of synthesis, and evidence for multiple molecular states. J. biol. Chem. 246, 1732–1745 (1971). II. Kinetic properties. J. biol. Chem. 246, 1756–1755 (1971).
Author information
Authors and Affiliations
Rights and permissions
About this article
Cite this article
Klemme, JH. Allosterische Kontrolle der Pyruvatkinase aus Rhodospirillum rubrum durch anorganisches Phosphat und Zuckerphosphatester. Archiv. Mikrobiol. 90, 305–322 (1973). https://doi.org/10.1007/BF00408926
Received:
Issue Date:
DOI: https://doi.org/10.1007/BF00408926