Summary
Reduced forms of benzyl viologen, methyl viologen and FMN are utilized as electron donors by nitrate reductase A. Benzyl viologen is the most efficient donor of these 3 electron carriers; it has the lowest Michaelis constant. Our results suggest that the reduced viologens and FMNH2 donate their electrons directly to the enzyme.
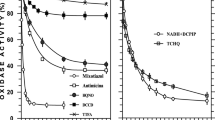
Crude extracts of A. aerogenes and M. denitrificans containing nitrate reductase A catalyze the oxidation of NADH2 by nitrate under anaerobic conditions. Under the same conditions NADPH2 does not serve as an electron donor. The following treatments cause the loss of NADH2-nitrate reductase and NADH2 oxidase activities in extracts of M. denitrificans without inactivating enzyme A (estimated in presence of benzyl viologen): (a) action of sodium deoxycholate 0,1 M; (b) heating at 55° C for 4 min. These results, as well as observations of other authors, show that the nitrate reductase A is not a pyridine nucleotide enzyme and that the electrons from NADH2 are transferred to nitrate reductase through intermediate electron carriers. The reduction of NO3 - to NO2 - at the expense of NADH2 catalyzed by an extract of M. denitrificans is inhibited 60% by the presence of O2.
Résumé
Les formes réduites du benzyl-viologène, du méthyl-viologène et du FMN sont utilisées comme donneuses d'électrons par la nitrate-réductase A. Le benzyl-viologène est le plus efficace de ces 3 transporteurs: c'est lui qui fournit la plus faible constante de Michaelis. Nos résultats appuient l'opinion selon laquelle les indicateurs viologènes réduits et le FMNH2 céderaient directement leurs électrons à l'enzyme.
Les extraits bruts d'A. aerogenes et M. denitrificans contenant la nitrate-réductase A catalysent, en anaérobiose, l'oxydation du NADH2 par le nitrate. Dans les mêmes conditions, le NADPH2 ne sert pas de donneur d'électrons. Les traitements suivants font perdre aux extraits de M. denitrificans leurs activités NADH2-nitrate-réductase et NADH2-oxydase sans inactiver l'enzyme A (dosé en présence de benzyl-viologène): (a) action d'un détergent: le désoxycholate de sodium à la concentration 0,1 M; (b) chauffage à 55° C pendant 4 min. Ces résultats, ainsi que les observations faites par d'autres chercheurs, démontrent que la nitrate-réductase A n'est pas un enzyme à pyridine-nucléotide, et que les électrons issus du NADH2 lui sont transférés indirectement par l'intermédiaire d'une chaîne de transporteurs et non pas directement. L'oxygène inhibe de 60% la réduction de NO3 - en NO2 - aux dépens du NADH2 catalysée par un extrait de M. denitrificans.
Similar content being viewed by others
Références
DeMoss, J. A.: Communication personnelle.
Fewson, C. A., and D. J. D. Nicholas: Nitrate reductase from Pseudomonas aeruginosa. Biochim. biophys. Acta (Amst.) 49, 335–349 (1961).
Forget, P.: Communication personnelle
Hackenthal, E., u. R. Hackenthal: Die Nitratreduktion durch zellfreie Extrakte aus Bacillus cereus. Biochim. biophys. Acta (Amst.) 107, 189–202 (1965).
Heredia, C. F., and A. Medina: Nitrate reductase and related enzymes in Escherichia coli. Biochem. J. 77, 24–30 (1960).
Jacobs, N. J., and P. J. van Demark: Comparison of the mechanism of glycerol oxidation in aerobically and anaerobically grown Streptococcus faecalis. J. Bact. 79, 532–538 (1960).
Lowe, R. H., and H. J. Evans: Preparation and some properties of a soluble nitrate reductase from Rhizobium japonicum. Biochim. biophys. Acta (Amst.) 85, 377–389 (1964).
Murray, E. D., and B. D. Sanwal: An immunological enquiry into the identity of assimilatory and dissimilatory nitrate reductase from Escherichia coli. Canad. J. Microbiol. 9, 781–790 (1963).
Nicholas, D. J. D., and A. Nason: Diphosphopyridine nucleotide-nitrate reductase from Escherichia coli. J. Bact. 69, 580–583 (1955).
Pichinoty, F.: A propos des nitrate-réductases d'une bactérie dénitrifiante. Biochim. biophys. Acta (Amst.) 89, 378–381 (1964a).
—: Contribution à l'étude des nitrate-réductases respiratoires bactériennes. C. R. Soc. Biol. (Paris) 158, 1122–1125 (1964b).
—: Les nitrate-réductases bactériennes. I. — Substrats, état particulaire et inhibiteurs de l'enzyme A. Arch. Mikrobiol. 68, 51–64 (1969).
—, E. Azoulay, P. Couchoud-Beaumont, L. Le Minor, C. Rigano, J. Bigliardi-Rouvier et M. Piéchaud: Recherche des nitrate-réductases bactériennes A et B: résultats. Ann. Inst. Pasteur 116, 27–42 (1969).
Pichinoty, F., et M. Chippaux: Recherches sur des mutants bactériens ayant perdu les activités catalytiques liées à la nitrate-réductase A. III. Caractères biochimiques. Ann. Inst. Pasteur (sous presse).
—, et M. Piéchaud: Recherche des nitrate-réductases bactériennes A et B: méthodes. Ann. Inst. Pasteur 114, 77–98 (1968).
Sadana, J. C., and W. D. McElroy: Nitrate reductase from Achromobacter fischeri. Purification and properties: function of flavines and cytochrome. Arch. Biochem. Biophys. 67, 16–34 (1957).
Taniguchi, S., and E. Itagaki: Nitrate reductase of nitrate respiration type from E. coli. I. Solubilization and purification from the particulate system with molecular characterization as a metalloprotein. Biochim. biophys. Acta (Amst.) 44, 263–279 (1960).
—, R. Sato, and F. Egami: The enzymatic mechanisms of nitrate and nitrite metabolism in bacteria. Inorganic Nitrogen Metabolism. Baltimore: The Johns Hopkins Press 1956.
van't Riet, J., A. H. Stouthamer, and R. J. Planta: Regulation of nitrate assimilation and nitrate respiration in Aerobacter aerogenes. J. Bact. 96, 1455–1464 (1968).
Wainwright, S. D.: Menadione derivatives and ferrous iron as cofactors of the nitrate reductase system of a coliform organism. Biochim. biophys. Acta (Amst.) 18, 583–585 (1955).
Author information
Authors and Affiliations
Rights and permissions
About this article
Cite this article
Pichinoty, F. Les nitrate-réductases bactériennes. Archiv. Mikrobiol. 68, 65–73 (1969). https://doi.org/10.1007/BF00408447
Received:
Issue Date:
DOI: https://doi.org/10.1007/BF00408447