Summary
After the injection of DANS-tryptophan into the 3rd ventricle of white rats, the temporal absorption and distribution of the fluorescence marked amino acid in the central nervous system was examined with fluorescence microscopic techniques. The results are as follows:
-
1.
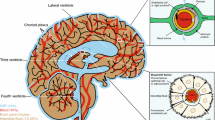
Ependyma. Increased fluorescence of the resorbed DANS-tryptophan was observed in the ependyma of both lateral ventricles, the 3rd ventricle and the aquaeduct up to 15 min after the injection. Afterwards, no further fluorescence could be demonstrated. All ependymal cells are resorbing the amino acid in uniform manner. There is a distinct limitation of fluorescent ependymal wall against subependymal brain tissue. The ependyma of the 4th ventricle is not fluorescent.
-
2.
Choroid plexus. 3 min p.i. fluorescence arises in the choroid plexus of lateral ventricles and 3rd ventricle, remaining there longer than in the ependyma, firstly being removed 120 min p.i. There is no fluorescence in the choroid plexus of the 4th ventricle.
-
3.
Brain tissue. Being resorbed by the ependyma cells, DANS-tryptophan is distributed with varying temporal differences in the surrounding brain regions. Distribution preference is as follows: Hypothalamus and basal ganglia (3 min p.i.); septal-, periventricular-, and preoptic nuclei, and gray matter surrounding the aquaeduct (5 min p.i.). Hippocampus, dentate gyrus and thalamus are showing distinct fluorescence not before 10 and 20 min p.i. The tryptophan is found sporadically in the pericarya and fibres (hypothalamus, basal ganglia and mid-brain), in most nuclear areas however, it was restricted to the pericarya. Loss or decrease of fluorescence intensity is time dependent and proceeds in caudal direction. The preoptic nuclear region firstly can be found as to be free of tryptophan (30 min p.i.). During this time, an increase in fluorescence of the brain-stem in the mid-brain and 4th ventricular region is observed and is maintained in nerve fibres until the end of the experiment. At the base of the 4th ventricle fluorescence is restricted to the nerve fibres principally in the reticular formation and nuclear region of the brain nerves. Fluorescent pericarya of a particular cell type are observed during the entire experiment in the cerebellar molecular layer. The preferential fluorescence distribution in the white matter is as follows: Fornix and anterior commissure, connections between thalamus, hypothalamus, cortex, stria terminalis and septal region; zona incerta, Forel fields, crus cerebri and habenular region. Similar the mid-brain tracts around the aquaeduct, Schütz bundle and specially the reticular formation. With regards to various distribution patterns and fluorescence intensity the transport of tryptophan from diencephalon to caudal areas around the aquaeduct and upper brain stem is discussed.
Zusammenfassung
Nach Injektion von DANS-Tryptophan in den III. Ventrikel von Ratten wurden Aufnahme und Verteilung der Aminosäure im Zentralnervensystem im Zeitexperiment fluoreszenzmikroskopisch untersucht. Folgende Befunde wurden erhoben:
-
1.
Ependym. Das Ependym der Seitenventrikel, des III. Ventrikels und des Aquaedukts resorbiert DANS-Tryptophan bis 15 min p.i. Später ist in den Ependymzellen keine Fluoreszenz mehr zu beobachten. Alle Ependymzellen dieser Ventrikelabschnitte resorbieren das markierte Tryptophan in einheitlicher Weise. Das fluoreszierende Ependym ist gegen das subependymale Hirngewebe scharf abgegrenzt. Das Ependym des IV. Ventrikels dagegen bleibt fluoreszenzfrei.
-
2.
Plexus chorioideus. Fluoreszenz tritt in den Plexusepithelien der Seitenventrikel und des III. Ventrikels 3 min p.i. auf. Sie ist länger als im Ependym zu beobachten und erlischt erst nach 120 min. Die Plexus chorioidei des IV. Ventrikels zeigen dagegen keine Fluoreszenz.
-
3.
Hirngewebe. Nach der Resorption durch das Ependym wird DANS-Tryptophan mit zeitlichen Unterschieden an umschriebene Hirnareale abgegeben. Bevorzugt werden folgende Kerngebiete: Hypothalamus und Basalganglien (3 min p.i.); Septumkerne, periventrikuläre und praeoptische Kerne, graue Substanz um den Aquaedukt (5 min p.i.). Im Hippocampus, Gyrus dentatus und Thalamus erscheinen fluoreszierende Strukturen erst 10 und 20 min p.i. Das markierte Tryptophan tritt stellenweise in Perikaryen und Fortsätzen (Hypothalamus und Basalganglien, Mittelhirn) auf, in den meisten Kerngebieten beschränkt es sich aber auf Perikaryen. Verlust oder Rückgang der Fluoreszenzintensität sind zeitabhängig und schreiten von rostral nach caudal fort. Zuerst (30 min p.i.) werden die präoptischen Kerngebiete tryptophanfrei. Die Fluoreszenz des Hirnstamms im Gebiet des Mittelhirns und des IV. Ventrikels nimmt währenddessen zu und bleibt in Zellfortsätzen bis zum Ende der Versuchszeit erhalten. Im Boden des IV. Ventrikels ist die Fluoreszenz auf Zellfortsätze beschränkt, hauptsächlich in der Formatio reticularis und im Gebiet der Hirnnervenkerne. Während der gesamten Versuchszeit sind im Stratum moleculare des Kleinhirns fluoreszierende Perikaryen einer gleichartigen Zellart zu beobachten. Fluoreszenz in der weißen Substanz findet sich in Fornix und Commissura anterior, in Verbindungen zwischen Thalamus, Hypothalamus, Cortex, Stria terminalis und Septumregion; in der Zona incerta, in den Forelschen Feldern, im Crus cerebri und in der Habenularregion sowie in den Mittelhirnbahnen um den Aquaedukt, im Schützschen Bündel und besonders stark in der Formatio reticularis. Wegen der unterschiedlichen Verteilung und Intensität wird ein Transport des Tryptophans aus dem Zwischenhirn in caudale Areale um den Aquaeduct und oberen Hirnstamm diskutiert.
Similar content being viewed by others
Literatur
Adam, H.: Bewegung der Cerebrospinalflüssigkeit bei niederen Wirbeltieren. Wien. Z. Nervenheilk. Suppl. I, 70–74 (1966).
Bogdanski, D. F., Weissbach, H., Udenfriend, S.: The distribution of serotonin, 5-hydroxytryptophandecarboxylase and monoamine oxidase in brain. J. Neurochem. 1, 272 (1957).
Brightman, M. W.: The distribution within the brain of ferritin injected into cerebrospinal fluid compartments. J. Cell Biol. 26, 99–123 (1965).
Carmichael, E. A., Feldberg, W., Fleischhauer, K.: Methods for perfusing different parts of the cat's cerebral ventricles with drugs. J. Physiol. (Lond.) 173, 354–367 (1964).
Carmichael, E. A., Feldberg, W., Fleischhauer, K.: Effects of tubocurarine perfused through different parts of the cerebral ventricles. J. Physiol. (Lond.) 175, 303–319 (1964).
Carpenter, S. J., McCarthy, L. E., Borison, H. L.: Electron microscopic study on the epiplexus (Kolmer) cells of the cat choroid plexus. Z. Zellforsch. 110, 471–486 (1970).
Carvalho, C. A. F. de: Considerations on the ependyma of the encephalic ventricles of Tropidonotus natrix, Alligator mississipiensis and Testudo graeca. Acta anat. (Basel) 76, 352–381 (1970).
Dahlström, A., Fuxe, K.: Evidence for the existence of monoamine containing neurons in the central nervous system. I. Demonstration of monoamines in the cell bodies of brain stem neurons. Acta physiol. scand. 62, Suppl. 232, 1–55 (1965).
Dahlström, A., Fuxe, K.: Evidence for the existence of monoamine containing neurons in the central nervous system. II. Experimentally induced changes in the intraneuronal amine levels of bulbospinal neuron systems. Acta physiol. scand. 64, Suppl. 247, 1–36 (1965).
Draskoci, M., Feldberg, W., Fleischhauer, K., Haranath, P. S. R.: Absorption of histamine into the blood stream on perfusion to the cerebral ventricles, and its uptake by brain tissue. J. Physiol. (Lond.) 150, 50–66 (1960).
Feldberg, W., Fleischhauer, K.: Penetration of bromphenolblue from the perfused cerebral ventricles into the brain tissue. J. Physiol. (Lond.) 150, 451–462 (1960).
Fleischhauer, K.: Fluoreszenzmikroskopische Untersuchungen über den Stofftransportzwischen Ventrikelliquor und Gehirn. Z. Zellforsch. 62, 639–654 (1964).
Franz, H., Stark, M.: Fluoreszenzmikroskopische Untersuchungen über die Resorption und Verteilung von Tetracyclin im Rattenhirn nach intraventrikulärer Injektion. Z. Zellforsch. 126, 565–579 (1972).
Fuxe, K.: Evidence for the existence of monoamine containing neurons in the central nervous systems. III. The monoamine nerve terminal. Z. Zellforsch. 65, 573–596 (1965).
Fuxe, K.: Evidence for the existence of monoamine containing neurons in the central nervous system. IV. Distribution of monoamine nerve terminals in the central nervous system. Acta physiol. scand. 64, Suppl. 247, 37–85 (1965).
Fuxe, K., Ungerstedt, U.: Localization of 5-hydroxytryptamine uptake in rat brain after intraventricular injection. J. Pharm. Pharmacol. 19, 335–337 (1967).
Fuxe, K., Ungerstedt, U.: Histochemical studies on the distribution of catecholamines and 5-hydroxytryptamine after intraventricular injections. Histochemie 13, 16–28 (1968).
Garattini, S., Valzelli, L.: Serotonin. Amsterdam-London-New York: Elsevier Publishing Company 1965.
Grahame-Smith, D. G.: The enzymatic conversion of tryptophan into 5-hydroxytryptophan by isolated brain tissue. Biochem. J. 92, 52 P (1964).
Klatzo, I., Miquel, J., Ferris, P. J., Prokop, J. D., Smith, D. E.: Observations on the passage of the fluorescein labelled serum proteins in cerebrospinal fluid. J. Neuropath. exp. Neurol. 23, 19–34 (1964).
König, J. F. R., Klippel, R. A.: The rat brain. A stereotaxis atlas of the forebrain and lower parts of the brain stem. Baltimore: Williams & Wilkins Company 1963.
Leonhardt, H.: Das Ependym. In: Zirkumventrikuläre Organe und Liquor. Bericht über das Symposium in Schloß Reinhardsbrunn vom 13. bis 16. Mai 1968, S. 177–190, Hrsg. G. Sterba. Jena: VEB Fischer 1969.
Leonhardt, H.: Subependymale Basalmembranlabyrinthe im Hinterhorn des Seitenventrikels des Kaninchengehirns. Z. Zellforsch. 105, 595–604 (1970).
Lovenberg, W., Jequier, E., Sjoerdsma, A.: Tryptophan hydroxylation; measurement in pineal gland, brain stem and carcinoid tumor. Science 155, 217 (1967).
Mayersbach, H. v.: Immunhistologische Methoden. II. Ein weiterer Markierungsfarbstoff: Dimethyl-1-Naphthylamin-sulfonsäure-5. Acta histochem. (Jena) 5, 351–368 (1958).
Meller, K., Breipohl, W., Wagner, K. H.: Die Inkorporation von Leucin-H3 in Plexus choroideus-Zellen in der Gewebekultur. Z. Zellforsch. 104, 116–126 (1970).
Oksche, A.: Die Bedeutung des Ependyms für den Stoffaustausch zwischen Liquor und Gehirn. Anat. Anz., Erg. Bd. 103, 162–171 (1956).
Paasonen, M. K., MacLean, P. D., Giarman, N. J.: 5-hydroxytryptamine (serotonin, enteramine) content of structures of the limbic system. J. Neurochem. 1, 326 (1957).
Smith, D. E., Streicher, E., Milkovic, K., Klatzo, I.: Observations on the transport of proteins by the isolated plexus. Acta neuropath. (Wien) 3, 372–386 (1964).
Tani, L. J., Ametani, T.: Sodium localization in the choroid plexus. Z. Zellforsch. 112, 42–53 (1971).
Weber, L. J., Horita, A.: A study of 5-hydroxytryptamine formation from L-tryptophan in the brain and other tissues. Biochem. Pharmacol. 14, 1141 (1965).
Zeman, W., Innes, J. R. M.: Craigie's neuroanatomy of the rat. New York and London: Academic Press 1963.
Author information
Authors and Affiliations
Additional information
Unseren Eltern in Dankbarkeit gewidmet.
Frau Traute Felsing und Frl. Ingeborg Lorenz danken wir für bewährte technische Assistenz.
Durchgeführt mit dankenswerter Unterstützung durch die Deutsche Forschungsgemeinschaft.
Rights and permissions
About this article
Cite this article
Stark, M., Franz, H. Resorption und Verteilung von DANS-markiertem Tryptophan im Rattenhirn nach intraventrikulärer Injektion. Z.Zellforsch 126, 536–564 (1972). https://doi.org/10.1007/BF00306910
Received:
Issue Date:
DOI: https://doi.org/10.1007/BF00306910