Summary
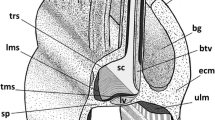
The ampullate gland duct in Araneus diadematus consists of three long segments surrounded by the same sheath of multi-layered conjunctival tissue rich in glycogen. The duct segments have a single epithelial layer resting on a fibrillar basement membrane and a thick cuticular intima. The epithelial cells are rich in microtubules and their apices carry microvilli. The cuticular intima consists of an acid-mucopolysaccharide-rich sub-cuticle, an endocuticle, and a classical epicuticle. The endocuticle shows two types of alternating bands, which are electron-dense or clear, and are spirally wound over the length of the cuticular stem. The dense bands contain a network of twisted and anastomosing canaliculi. The clear bands do not show any obvious structural patterns.
In the proximal end of the first segment, the epithelial cells are richer in microtubules than in other parts of the duct, the number of apical microvilli decreases, the sub-cuticle disappears, and the endocuticle, which becomes five times thicker than in the other segments, forms a loose network showing an infrastructure of canaliculi towards the cells, and a fibrous, granular zone towards the epicuticle.
The actual junction of the duct and the glandular ampulla is effected by a differentiation of the epicuticle and the plasma membranes of the proximal glandular cells.
We propose that the structures of the proximal segment of the duct lend themselves to a deformation that follows the passage of secretory products; the structure of the following segments seems to be related to water absorption from the duct lumen towards hemolymph.
Résumé
Le canal des glandes ampullacées d'Araneus diadematus comprend trois longs segments entourés d'une même gaine conjonctive pluristratifiée et riche en glycogène. La structure générale de ces segments est caractérisée par un épithélium simple reposant sur une lame basale fibrillaire et une intima cuticulaire épaisse. Les cellules épithéliales sont riches en microtubules et leur apex est garni de microvillosités. L'intima cuticulaire comporte une sous-cuticule pourvue de mucopolysaccharides acides, une endocuticule, et une épicuticule de structure classique. L'endocuticule est formée de deux sortes de bandes, en alternance, claires ou denses aux électrons, enroulées en spirale le long du manchon cuticulaire; les bandes denses comprennent un réseau de canalicules contournés et anastomosés; le matériel des bandes claires ne présente pas de structure apparente.
Dans la partie proximale du premier segment du canal, les cellules épithéliales sont plus riches en microtubules; les microvillositées apicales sont plus rares; la sous-cuticule disparaît et l'endocuticule, devenue cinq fois plus épaisse que dans les autres segments, est formée, du côté des cellules, d'un réseau à larges mailles présentant une infrastructure canaliculaire, et, du côté de l'épicuticule, d'une zone granulo-fibreuse.
La jonction proprement dite du canal et de l'ampoule glandulaire est réalisée grâce à une différenciation de l'épicuticule et des membranes plasmiques des cellules glandulaires proximales.
Il est proposé de relier les structures décrites à des fonctions de deux types; la structure du segment proximal du canal serait propre à amortir des déformations consécutives au passage des produits de sécrétion; celle des segments suivants paraît correspondre à des phénomènes d'absorption d'eau qui se produiraient depuis la lumière du canal jusqu'au milieu intérieur de l'araignée.
Similar content being viewed by others
Bibliographie
Adams, C. W. M.: A stricter interpretation of ferric ferrycyanide reaction with particular reference to the demonstration of protein-bound sulphydryl and disulphide groups. J. Histochem. Cytochem. 4, 23–35 (1956).
Andersen, S. O.: Amino acid composition of spider silks. Comp. Biochem. Physiol. 35, 705–713 (1970).
Apstein, C.: Bau und Funktion der Spinndrüsen der Araneidae. Arch. Natur. Gesch. 55, 29–74 (1889).
Barth, F. G.: Die Feinstruktur des Spinneninteguments. I. Die Cuticula des Laufbeins adulter häutungsferner Tiere (Cupiennius salei Keys). Z. Zellforsch. 97, 137–159 (1969).
Barth, F. G.: Die Feinstruktur des Spinneninteguments. II. Die räumliche Anordnung der Mikrofasern in der lamellierten Cuticula und ihre Beziehung zur Gestalt der Porenkanäle (Cupiennius salei Key., adult, häutungsfern, Tarsus). Z. Zellforsch. 104, 87–106 (1970).
Bassot, J. M., Martoja, R.: Données histologiques et ultrastructurales sur les microtubules cytoplasmiques du canal éjaculateur des Insectes Orthoptères. Z. Zellforsch. 74, 145–181 (1966).
Bell, A. L., Peakall, D. B.: Change in fine structure during silk protein production in the cell of silk spinning gland of the spider Araneus sericatus. J. Cell Biol. 42, 284–295 (1969).
Bouligand, Y.: Sur une architecture torsadée répandue dans de nombreuses cuticules d'Arthropodes. C.R. Acad. Sci. (Paris) 261, 3665–3668 (1965).
Gabe, M.: Quelques applications de la coloration par la fuchsine-paraldéhyde. Bull. Micro. appl. (2), 3, 152–161 (1953).
Gabe, M., Martoja, M.: Une coloration trichrome en un temps, sans différenciation. Bull. Micr. appl. (2), 7, 50–53 (1957).
Heidenhain, M.: Über die Mallorysche Bindegewebsfärbung mit Karmin und Azokarmin als Vorfarben. Z. wiss. Mikr. 32, 361–372 (1915).
Hopfmann, W.: Bau und Leistung des Spinnapparates einiger Netzspinnen. Jenaische Z., 70, 65–112 (1935).
Johansson, B.: Zur Kenntnis der Spinndrüsen der Araneidae. Acta Univ. Lund., N. S., 10, 5e art., 1–11 (1914).
Judy, K. J., Gilbert, L. I.: Histology of the alimentary canal during the metamorphosis of Hyalophora cecropia (L.). J. Morph. 131, 277–300 (1970).
Kovoor, J.: Etude histochimique et cytologique des glandes séricigènes de quelques Argiopidae. Ann. Sci. nat. Zool., (Paris), 12e S., 14, 1–40 (1972).
Krishnakumaran, A.: A comparative study of the Arachnid cuticle. II. Chemical nature. Z. vergl. Physiol. 44, 478–486 (1961).
Krishnakumaran, A.: A comparative study of the cuticle in Arachnida. I. Structure and staining properties. Zool. Jb. Abt. Anat. u. Ontog. 80, 49–64 (1962).
Lillie, R. D.: Histopathologic technic and practical histochemistry, 3d. ed. New York: Mc Graw Hill 1965.
Lison, L.: Histochimie et cytologie animale, 3e ed. Paris: Gauthier-Villars 1960.
Locke, M.: The structure and formation of the integument in insects. In: The physiology of insecta, vol. III, Rockstein M. (ed.), p. 379–470, New-York-London: Academic Press 1964.
Locke, M.: Permeability of insect cuticle to water and lipids. Science 147, 295–298 (1965).
Locke, M.: The structure and formation of the cuticulin layer in the epicuticle of an insect, Calpodes ethlius (Lepidoptera, Hesperidae). J. Morph. 118, 461–494 (1966).
Martoja, R., Cantacuzéne, A. M.: Données histologiques sur les mucopolysaccharides acides cuticulaires des Orthoptères. C.R. Acad. Sci. (Paris) D 268, 697–700 (1969).
Nemenz, H.: Die Kutikula und Kutikulastrukturen von Gasteracantha cancriformis (L. 1758) (Araneae, Araneidae, Gasteracanthinae). Z. wiss. Zool. 169, 82–114 (1963).
Noirot, C., Noirot-Timothée, C.: Un nouveau type de jonction intercellulaire (zonula continua) dans l'intestin moyen des Insectes. C.R. Acad. Sci. (Paris) D 264, 2796–2798 (1967).
Noirot, C., Noirot-Thimothée, C.: La cuticule proctodéale des Insectes. I. Ultrastructure comparée. Z. Zellforsch. 101, 477–509 (1969).
Noirot-Timothée, C., Noirot, C.: Attache de microtubules sur la membrane cellulaire dans le tube digestif des Termites. J. Microsc. 5, 715–724 (1966).
Peakall, D. B.: Synthesis of silk, mechanism and location. Amer. Zoologist 9, 71–79 (1969).
Peters, H. M.: Über den Spinnapparat von Nephila madagascariensis. Z. Naturforsch. 106, 395–404 (1955).
Peters, W.: Die Feinstruktur der Kutikula von Atemorganen einiger Arthropoden. Z. Zellforsch. 93, 336–365 (1969).
Ravetto, C.: Alcian blue-alcian yellow. A new method for the identification of different acidic groups. J. Histochem. Cytochem. 12, 44–45 (1964).
Reynolds, E. S.: The use of lead citrate at high pH as an electron-opaque stain in electron microscopy. J. Cell Biol. 17, 208–212 (1963).
Richards, A. G.: The integument of arthropods. Minneapolis: University of Minneapolis Press 1951.
Sandborn, N., Koen, P. F., McNabb, J. D., Moore, G.: Cytoplasmic microtubules in mammalian cells. J. Ultrastruct. Res. 11, 123–138 (1964).
Schmidt, E. L.: Observation on a subcuticular layer in the insect integument. J. Morph. 99, 211–232 (1956).
Sekiguchi, K.: The spinning organs in sub-adult geometric spiders and their changes accompanying the last moulting. Sci. Rep. Tokyo Kyoiku Daigaku, Sect. B 8, 33–40 (1955).
Sewell, M. T.: Pore canals in a spider cuticle of a spider. Nature (Lond.) 167, 857 (1951).
Swell, M. T.: The histology and histochemistry of the cuticle of a spider, Tegenaria domestica (L.). Ann. entomol. Soc. Amer. 48, 107–118 (1955).
Slautterback, D. B.: Cytoplasmic microtubules. I. Hydra. J. Cell Biol. 18, 367–388 (1963).
Stuart, A. M., Satir, P.: Morphological and functional aspects of an insect epidermal gland. J. Cell Biol. 36, 527–550 (1968).
Taylor, R. L., Richards, A. G.: Integumentary changes during moulting of arthropods with special reference to the subcuticle and ecdysial membrane. J. Morph. 116, 1–22 (1965).
Thiery, J. P.: Mise en évidence des polysaccharides sur coupes fines en microscopie électronique. J. Microsc. 6, 987–1018 (1967).
Wigglesworth, V. B.: Some notes on the integument of insects in relation to the entry of contact insecticides. Bull. entomal. Res. 33, 205–218 (1942).
Witt, P. N., Reed, C. F., Peakall, D. B.: A spider's web. Problems in regulatory biology, 107 pp. Berlin-New York: Springer 1968.
Zylberberg, L.: Contribution à l'étude des glandes pharyngiennes de Messor capitatus Latr. (Hyménoptère, Formicide). 2e Thèse de D.-ès-Sc., Paris 1968, 19 pp. dactylographiées, 5 pl.
Author information
Authors and Affiliations
Additional information
Nous sommes reconnaissantes au Dr. M. Gabe des conseils qu'il nous a donnés au cours de la rédaction de ce mémoire.
Rights and permissions
About this article
Cite this article
Kovoor, J., Zylberberg, L. Morphologie et ultrastructure du canal des glandes ampullacées d'Araneus diadematus Clerck (Arachnida, Araneidae). Z.Zellforsch 128, 188–211 (1972). https://doi.org/10.1007/BF00306898
Received:
Issue Date:
DOI: https://doi.org/10.1007/BF00306898