Summary
-
a)
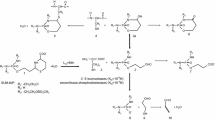
N-2-chloroethylamido-oxazaphosphorines such as cyclophosphamide, ifosfamide and trofosfamide differ from “non-oxazaphosphorine-substituted” (alkylating) N-mustards by the selectivity of their cancerotoxic action in vivo (measured by their therapeutic index) and by the fact that for exertion of their alkylating and cytotoxic properties they must first be transformed in the body. This bio-transformation is a multi-step process which commences with enzymatic hydroxylation at carbon 4 of the oxazaphosphorine ring (activation).
-
b)
Cancerotoxic selectivity is closely bound to the oxazaphosphorine ring. Transfer of a chloroethyl group from the extracyclic amide-nitrogen (cyclophosphamide) to the cyclic amide-nitrogen (ifosfamide) or replacement of a 2-chloroethyl group by a 2-mesyloxyethyl group leaves the essential basic properties of the N-2-chloroethylamido-oxazaphosphorines largely unchanged. In spite of this, some compounds show significant pharmacotherapeutic peculiarities regarding organotropic effects and cumulative properties.
-
c)
The cancerotoxic selectivity of the N-2-chloroethylamido-oxazaphosphorines in vivo is closely related to the cytotoxic specificity of their activated primary metabolites against cancer cells in vitro. In the case of 4-hydroxycyclophosphamide, these two properties are abolished by toxification and liberation of the strongly alkylating nitrogen mustard phosphorid acid diamide.
-
d)
The toxification is the rate-determining step of the spontaneous breakdown of 4-hydroxy-cyclophosphamide. It is pH-dependent and can be indirectly controlled by competitive deactivation reactions.
-
e)
Apart from enzymatic dehydrogenation of the primary activated metabolites of cyclophosphamide into non-toxic metabolites, a reversible nonenzymatically catalysed deactivation by thiol compounds is described. This does not involve the alkylating moiety of N-2-chloroethylamido-oxazaphosphorines, but the cyclic cryptoaldehyde group of activated oxazaphosphorines, leading to the formation of 4-(SR)-mercapto-oxazaphosphorines. Since free sulfhydryl groups or proteins were found to react according to the same mechanism, activated N-2-chloroethylamido-oxazaphosphorines can thus be bound to cellular structures and enzymes.
-
f)
The significance of the various deactivation reactions for cancerotoxic selectivity and cytotoxic specificity of N-2-chloroethylamido-oxazaphosphorines is discussed with particular regard to the importance of thiol deactivation for cytotoxic specifivity and cancerotoxic selectivity against tumor cells.
Zusammenfassung
-
a)
N-2-Chloroäthylamido-oxazaphosphorine, wie Cyclophosphamid, Ifosfamid und Trofosfamid, unterscheiden sich von „nicht Oxazaphosphorin-substituierten“ (alkylierenden) N-Lost-Verbindungen durch die Selektivität ihrer kanzerotoxischen Wirkung in vivo (gemessen am therapeutischen Quotienten) sowie durch die Tatsache, daß sie zur Entfaltung ihrer alkylierenden und cytotoxischen Eigenschaften einer Biotransformation bedürfen. Diese ist ein mehrstufiger Vorgang, der durch enzymatische Hydroxylierung am C-Atom 4 des Oxazaphosphorin-Rings (Aktivierung) eingeleitet wird.
-
b)
Die cancerotoxische Selektivität ist eng an die spezielle Ringstruktur des Oxazaphosphorin-Rings mit einer Propanolamin-Phosphorsäure-Ester-Gruppierung gebunden. Die Übertragung einer Chloräthylfunktion vom extracyclischen Amidstickstoff (Cyclophosphamid) auf den Amidstickstoff im Ring (Ifosfamid) sowie Ersatz einer 2-Chloräthylfunktion durch eine 2-Mesyloxyäthyl-Gruppe läßt die wesentlichen Eigenschaften der N-2-Chloräthylamido-oxazaphosphorine weitgehend unverändert. Trotzdem treten bei einzelnen Verbindungen pharmakotherapeutische Besonderheiten hervor. Sie betreffen vor allem die Ausprägung organotroper Wirkkomponenten und kumulativer Eigenschaften.
-
c)
Die cancerotoxische Selektivität der N-2-Chloräthylamido-oxazaphosphorine in vivo korreliert eng mit der cytotoxischen Spezifität ihrer aktivierten primären Metaboliten gegenüber Krebszellen im Inkubations-/Transplantations-Test. Im Falle von 4-Hydroxy-Cyclophosphamid gehen beide Eigenschaften mit der Giftung und der Freisetzung des stark alkylierenden N-Lost-Phosphorsäurediamid verloren.
-
d)
Die Giftung ist der geschwindigkeitsbestimmende Schritt des Spontanzerfalls von 4-Hydroxy-Cyclophosphamid. Sie ist pH-abhängig und kann (indirekt) durch konkurrierende Deaktivierungs-Reaktionen kontrolliert werden.
-
e)
Außer der enzymatischen Dehydrierung der primären aktivierten Metaboliten von Cyclophosphamid zu untoxischen Entgiftungsprodukten wird eine nicht enzymatisch katalysierte Deaktivierung durch Thiol-Verbindungen beschrieben. Auch bei dieser Reaktion ist nicht der alkylierende Molekülteil der N-2-Chloräthylamido-Oxazaphosphorine betroffen, sondern die ringständige Kryptoaldehydfunktion am Kohlenstoff 4 des aktivierten Oxazaphosphorin-Rings, wobei 4-(SR)-Mercapto-Oxazaphosphorine entstehen. Freie Sulfhydrylgruppen von Proteinen reagieren nach dem gleichen Mechanismus; demgemäß können aktivierte N-2-Chloräthylamido-Oxazaphosphorine auch an zelluläre Strukturen gebunden werden.
-
f)
Die mögliche Bedeutung der Deaktivierungs-Reaktion für die kanzerotoxische Selektivität und die cytotoxische Spezifität der N-2-Chloräthylamido-oxazaphosphorine wird diskutiert unter besonderer Berücksichtigung der Thiol-Deaktivierung für die cytotoxische Spezifität gegenüber Krebszellen in vitro.
Similar content being viewed by others
References
Alarcon, R.A., Meienhofer, J.: Formation of the cytotoxic aldehyde acrolein during in vitro degradation of cyclophosphamide. Nature New Biology 233, 250–252 (1971)
Alarcon, R.A., Meienhofer, J., Atherton, E.: Isophosphamide as a new acrolein-producing antineoplastic isomer of cyclophosphamide. Cancer Res. 32, 2519–2523 (1972)
Albert, A.: Selective toxicity. In: Pharmacological Basis of Cancer Chemotherapy. Baltimore: The Williams & Wilkins Company 1975
Allen, L.M., Creaven, P.J.: Human pharmacokinetic model for isophosphamide (NSC-109724). Cancer Chemother. Rep. Part 1, 59, 877–882 (1975)
Ariens, E.J.: Drug design and cancer. In: Pharmacological Basis of Cancer Chemotherapy. Baltimore: The Williams & Wilkins Company 1975
Arnold, H., Bourseaux, F., Brock, N.: Neuartige Krebs-Chemotherapeutika aus der Gruppe der zyklischen N-Lost-Phosphamidester. Naturwissenschaften 45, 64 (1958)
Arnold, H., Bourseaux, F., Brock, N.: Über Beziehungen zwischen chemischer Konstitution und cancerotoxischer Wirkung in der Reihe der Phosphamidester des Bis- (β-chloräthyl)-amins. Arzneimittel-Forsch. (Drug Res.) 11, 143–158 (1961)
Bardos, T.J., Chmielewicz, Z.F., Hobron, P.: Structure-activity relationships of alkylating agents in cancer chemotherapy. Ann. N. Y. Acad. Sci. 163, 1006–1025 (1969)
Botzenhardt, U., Lemmel, E.M.: Immunsuppression und Toleranzinduktion durch 3-(2-Chloräthyl)-2-(2-mesyloxyäthylamino)-tetrahydro-2H-1,3,2-oxazaphosphorin-2-oxid (ASTA 5122). Arzneimittel-Forsch. (Drug Res.) 24, 1167–1172 (1974)
Botzenhardt, U., Lemmel, E.-M.: Immunsuppression durch Alkylantien: Hinweise auf die Überlegenheit von 5122 ASTA gegenüber Cyclophosphamid. Verh. Dtsch. Ges. inn. Med. 81, 1191–1193 (1975)
Brock, N.: Zur pharmakologischen Charakterisierung zyklischer N-Lost-Phosphamidester als Krebs-Chemotherapeutika. Arzneimittel-Forsch. (Drug Res.) 8, 1 (1958)
Brock, N.: Pharmacologic characterization of cyclophosphamide (NSC-26271) and cyclophosphamide metabolites. Cancer Chemother. Rep. 51, 315–325 (1967)
Brock, N.: Pharmacological studies with ifosfamide, a new oxazaphosphorine compound. In: Advances in Antimicrobial and Antineoplastic Chemotherapy, Proceedings of the VII th Int. Congress of Chemotherapy, Prague, 1971. München-Berlin-Wien: Urban & Schwarzenberg 1972
Brock, N.: Pharmakologische Untersuchungen mit Trofosfamid (Ixoten®), einem neuen Oxazaphosphorinoxid. Med. Mschr. 27, 390–394 (1973)
Brock, N.: Comparative pharmacologic study in vitro and in vivo with cyclophosphamide (NSC-26271), cyclophosphamide metabolites and plain nitrogen mustard compounds. Cancer Treatment Reports 60, 301–307 (1976)
Brock,N.: Experimental basis of cancer chemotherapy. 9th Int. Chemotherapy Congress, London, 1975 (in press)
Brock,N.: Unpublished studies
Brock, N., Hoefer-Janker, H., Hohorst, H.J., Scheef, W., Schneider, B., Wolf, H.C.: Die Aktivierung von Ifosfamid an Mensch und Tier. Arzneimittel-Forsch. (Drug Res.) 23, 1–14 (1973)
Brock, N., Hohorst, H.J.: Über die Aktivierung von Cyclophosphamid im Warmblüterorganismus, Naturwissenschaften 49, 610–611 (1962)
Brock, N., Gross, R., Hohorst, H.J., Klein, H.O., Schneider, B.: Activation of cyclophosphamide in man and animals. Cancer 27, 1512–1529 (1971)
Brock, N., Hohorst, H.J.: Zur Frage der Knochenmarksschädigung durch cancerotoxische Substanzen. Klin. Wschr. 38, 69 (1960)
Brock, N., Hohorst, H.J.: Über die Aktivierung von Cyclophosphamid in vivo und in vitro. Arzneimittel-Forsch. (Drug Res.) 13, 1021–1031 (1963)
Brock, N., Kuhlmann, J.: Pharmacological studies with alkylsulfonyloxyalkyl substituted and chloroethyl substituted oxazaphosphorine-2-oxides. 1st Communication: Relationship between chemical structure and pharmacological action. Arzneimittel-Forsch. (Drug Res.) 24, 1139–1149 (1974)
Brock, N., Potel, J.: Pharmakologische Untersuchungen mit Alkylsulfonyloxyalkyl-bzw. Chloräthylsubstituierten Oxazaphosphorin-2-oxiden. 2. Mitteilung: Pharmakologische Charakterisierung von 2-Alkylsulfonyl-oxyalkylamino-oxazaphosphorin-2-oxiden unter Einbeziehung immunologischer Reaktionen. Arzneimittel-Forsch. (Drug Res.) 24, 1149–1160 (1974)
Brock, N., Schneider, B.: Probleme des Screenings und der Bewertung kanzerotoxischer Substanzen. In: Fortschritte der Krebsforschung. Hrsg. C.G.Schmidt, O.Wetter. Stuttgart: F.K.Schattauer-Verlag 1969
Brock, N., Wilmanns, H.: Wirkung eines zyklischen N-Lost-Phosphamidesters auf experimentell erzeugte Tumoren der Ratte. Dtsch. med. Wschr. 83, 453 (1958)
Bruce, W.R., Meeker, B.E., Valeriote, F.A.: Comparison of the sensitivity of normal hematopoietic and transplanted lymphoma colony-forming cells to chemotherapeutic agents administered in vivo. J. nat. Cancer Inst. 37, 233–245 (1966)
Clarke, F.E.: Determination of chloride in water. Anal. Chemistry 22, 553 (1950)
Connors, T.A., Cox, P.J., Farmer, P.B., Foster, A.B., Jarman, M.: Some studies of the active intermediates formed in the microsomal metabolism of cyclophosphamide and isophosphamide. Biochem. Pharmacol. 23, 115–129 (1974)
Cox, P.J., Phillips, B.J., Thomas, P.: The enzymatic basis of the selective action of cyclophosphamide. Cancer Res. 35, 3755–3761 (1975)
Deitrich, R.A.: Tissue and subcellular distribution of mammalian aldehyde-oxidizing capacity. Biochem. Pharmacol. 15, 1911–1922 (1966)
Draeger, U., Hohorst, H.J.: Permeation of cyclophosphamide (NSC-26271) metabolites into tumor cells. Cancer Treatment Reports 60, 423–427 (1976)
Draeger, U., Peter, G., Hohorst, H.J.: Deactivation of cyclophosphamide (NSC-26271) metabolites by sulfhydryl compounds. Cancer Treatment Reports 60, 355–359 (1976)
Drings, P., Allner, R., Brock, N., Burkert, H., Fischer, M., Fölsch, E., Gerhartz, H., Götzky, P., Hoppe, I., Kanzler, G., Klein, H.O., Mainzer, K., Martin, H., Obrecht, P., Palme, G., Paulisch, H., Riegg, H., Schubert, J.C.F., Treske, U., Weise, W., Willems, D., Wilmanns, H., Witte, S., Wohlenberg, H.: Erfahrungen mit neuartigen N-Lost-Phosphamidestern. Dtsch. med. Wschr. 95, 491–497 (1970)
Druckrey, H.: Experimentelle Grundlagen der Chemotherapie des Krebses, Dtsch. med. Wschr. 77, 1534–1537 (1952)
Druckrey, H.: Cancer Prevention. Acta Un. int. Cancer 13, 382 (1957)
Druckrey, H.: Theoretical use of chemotherapy in the treatment of carcinoma. J. Kanser (Ankara) 1, 131–149 (1969)
Druckrey, H., Steinhoff, F., Nakayama, M., Preussmann, R., Anger, K.: Experimentelle Beiträge zum Dosis-Problem in der Krebs-Chemotherapie und zur Wirkungsweise von Endoxan. Dtsch. med. Wschr. 88, 651 (1963)
Friedman, O.M., Boger, E.: Colorimetric estimation of nitrogen mustards in aqueous media. Hydrolytic behavior of bis(beta-chloroethyl)amine, nor HN2. Analytical Chemistry 33, 906 (1961)
Harper, N.J.: Drug latentiation. J. Med. Pharm. Chem. 1, 467 (1959)
Hill, D.L.: A review of cyclophosphamide. Springfield, Ill.: Charles C. Thomas Publ. 1975
Hill, D.L., Laster, W.R., Kirk, M.C, El Dareer, S., Struck, R.F.: Metabolism of phosphamide [2-(2-chloroethylamino)-3-(2-chloroethyl)tetrahydro-2H-1,3,2-oxazaphosphorine 2-oxide] and production of a toxic iphosphamide metabolite. Cancer Res. 33, 1016–1022 (1973)
Hill, D.L., Laster, W.R., Struck, R.F.: Enzymatic metabolism of cyclophosphamide and nicotine and production of a toxic cyclophosphamide metabolite. Cancer Res. 32, 658–665 (1972)
Hoefer-Janker, H., Scheef, W., Günther, U., Huls, W.: Erfahrungen mit der fraktionierten Ifosfamid-Stoßtherapie bei generalisierten malignen Tumoren. Med. Welt 26, 972–979 (1975)
Hohorst, H.J., Draeger, U., Peter, G., Voelcker, G.: The problem of oncostatic specificity of cyclophosphamide (NSC-26271): studies on reactions that control the alkylating and cytotoxic activity. Cancer Treatment Reports 60, 309–315 (1976)
Hohorst, H.J., Ziemann, A., Brock, N.: Herkunft und Spiegel von N,N-Bis-(2-chloräthyl)-amin im Serum nach Injektion von N,N-Bis-(2-chloräthyl)-N′,O-propylen-phosphorsäureester-diamid. Arzneimittel-Forsch. (Drug Res.) 16, 1529–1533 (1966)
Hohorst, H.J., Ziemann, A., Brock, N.: 4-Ketocyclophosphamide, a metabolite of cyclophosphamide. Formation, chemical and biological properties. Arzneimittel-Forsch. (Drug Res.) 21, 1254–1257 (1971)
Ishidate, M., Sakurai, Y., Yoshida, T., Sato, H., Sato, H., Matui, E.: Experimental studies on chemotherapy of malignant growth employing Yoshida sarcoma animals. Gann 44, 342–346 (1953)
Klein, H.O., Lennartz, K.J.: Chemotherapy after synchronization of tumor cells. Seminars in Hematology 11, 203–227 (1974)
Larionov, L.F.: Cancer chemotherapy. Oxford-London-Edinburgh-New York-Paris-Frankfurt: Pergamon Press 1965
Lenssen, U.: Untersuchungen über die Reaktion von 4-Hydroxycyclophosphamid mit Thiol-Verbindungen und über die Aufnahme von Cyclophosphamid und seinen Metaboliten in Tumorzellen. Inaugural-Dissertation, Fachbereich: Biochemie und Pharmazie, Universität Frankfurt/Main, 1976
Peter, G., Wagner, T., Hohorst, H.J.: Studies on 4-hydroperoxycyclophosphamide (NSC-181815): a simple preparation method and its application for the synthesis of a new class of “activated” sulfurcontaining cyclophosphamide (NSC-26271) derivatives. Cancer Treatment Reports 60, 429–435 (1976)
Potel, J., Brock, N.: Die immunsuppressive Wirkung verschiedener Cytostatika auf die humorale Antikörperbildung. Arzneimittel-Forsch. (Drug Res.) 21, 1250–1254 (1971)
Razek, A., Vietti, T., Valeriote, F.: Optimum time sequence for the administration of vincristine and cyclophosphamide in vivo. Cancer Res. 34, 1857–1861 (1974)
Ross, W.C.J.: The chemistry of cytotoxic alkylating agents. Advances in Cancer Res. 1, 397 (1953)
Ross, W.C.J.: In vitro reactions of biological alkylating agents. Ann. N. Y. Acad. Sci. 68, 669–681 (1958)
Ross, W.C.J.: Rational design of alkylating agents. In: Handbuch der experimentellen Pharmakologie, Vol. XXXVIII/1 (ed. Heffter-Heubner) S.33. Berlin-Heidelberg-New York: Springer 1974
Schmähl, D., Druckrey, H.: Beiträge zum Wirkungsmechanismus von N-Oxyd-Lost. Naturwissenschaften 43, 199 (1956)
Schnitker, J., Brock, N., Burkert, H., Fichtner, E.: Evaluation of a cooperative clinical study of the cytostatic agent Ifosfamide. Arzneimittel-Forsch. (Drug Res.) 26, 1783–1793 (1976)
Sladek, N.E.: Evidence for an aldehyde possessing alkylating activity as the primary metabolite of cyclophosphamide. Cancer Res. 33, 651–658 (1973)
Sladek, N.E.: Bioassay and relative cytotoxic potency of cyclophosphamide metabolites generated in vitro and in vivo. Cancer Res. 33, 1150–1158 (1973)
Stekar, J.: Chemotherapeutische Wirksamkeit von Ifosfamid an 6 verschiedenen isolog transplantierten Experimentaltumoren (BD-Ratten). Arzneimittel-Forsch. (Drug Res.), 26, 1793–1797 (1976)
Sugiura, K., Schmid, F.A., Schmid, M.M.: Antitumor activity of cytoxan. Cancer Res. 21, 1412–1420 (1961)
Struck, R.F., Kirk, M.C., Meilett, L.B., El Dareer, S., Hill, D.L.: Urinary metabolites of the antitumor agent cyclophosphamide. Molecular Pharmacology 7, 519–529 (1971)
Struck, R.F., Kirk, M.C., Witt, M.H., Laster jr., W.R.: Isolation and mass spectral identification of blood metabolites of cyclophosphamide: evidence for phosphoramide mustard as the biologically active metabolite. Biomedical Mass Spectrometry 2, 46–52 (1975)
Takamizawa, A., Matsumoto, S., Iwata, T., Katagiri, K., Tochino, Y., Yamaguchi, K.: Studies on cyclophosphamide metabolites and their related compounds. II. Preparation of an active species of cyclophosphamide and some related compounds. J. Am. Chem. Soc. 95, 985–986 (1973)
Voelcker,G.: Personal communication
Voelcker, G.: Untersuchungen über Reaktionen von 4-Hydroxycyclophosphamid, einem Metaboliten des Cyclophosphamid und die Identifizierung von Cyclophosphamid-Metaboliten in vivo. Inaugural-Diss., Fachbereich Biochemie und Pharmazie, Frankfurt 1976
Voelcker, G., Draeger, U., Peter, G., Hohorst, H.J.: Studien zum Spontanzerfall von 4-Hydroxycyclophosphamid und 4-Hydroperoxycyclophosphamid mit Hilfe der Dünnschichtchromatographie. Arzneimittel-Forsch. (Drug Res.) 24, 1172–1176 (1974)
Voelcker, G., Wagner, T., Hohorst, H.-J.: Identification and pharmacokinetics of cyclophosphamide (NSC-26271) metabolites in vivo. Cancer Treatment Rep. 60, 415–422 (1976)
Wagner,T., Peter,G., Voelcker,G., Hohorst,H.-J.: Identification and quantitative determination of “activated” cyclophosphamide in blood and urine. Cancer Res. (in press)
Weitzel, G., Buddecke, E., Schneider, F., Pfeil, H.: Einwirkung organischer Persauerstoff-Verbindungen auf das Mäuse-Ascitescarcinom in vivo. Hoppe-Seylers Z. Physiol. Chem 325, 65 (1961)
Williamson, C.E., Witten, B.: Reaction mechanism of some aromatic nitrogen mustards. Cancer Res. 27, 33–38 (1967)
Zubrod, C.G.: The development of drugs for the control of cancer. In: Pharmacological Basis of Cancer Chemotherapy. Baltimore: The Williams & Wilkins Company 1975
Author information
Authors and Affiliations
Additional information
Dedicated to Prof Dr. Hans Herken on the occasion of his 65 th birthday
With the support of Bundesministerium Forschung und Technologie
Rights and permissions
About this article
Cite this article
Brock, N., Hohorst, H.J. The problem of specificity and selectivity of alkylating cytostatics; studies on N-2-chloroethylamido-oxazaphosphorines. Z. Krebsforsch. 88, 185–215 (1977). https://doi.org/10.1007/BF00284124
Received:
Accepted:
Issue Date:
DOI: https://doi.org/10.1007/BF00284124