Abstract
Introduction
More than 60% of gastrointestinal stromal tumours (GISTs) arise from the stomach and about 20% from the small intestine. About 95% of GISTs express kit receptor tyrosine kinase (CD117), which is used for purposes of diagnosis and targeted treatment. However, kit expression alone is not specific for GIST, nor does it necessarily imply that signalling through the kit kinase is the driving oncogenic event. Poor prognostic features of GIST include involvement of the liver and other bulky sites of disease.
Patients and methods
We carried out a retrospective analysis of patients with CD117-positive leiomyosarcomas arising in the abdomen and treated through the Glivec International Patient Assistance Program (GIPAP) Clinic at the Nairobi Hospital between 7th November 2005 and 22nd November 2011.
Results
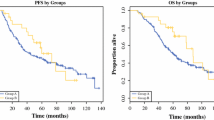
In total 54 patients were included. Males were 36 (66.7%) and females 18 (33.3%). The age range was 25–86 years and the median age 50 years. The stomach was involved primarily in 22 of 47 cases evaluable (46.8%). The liver was primarily involved in 3 (6.4%) and liver metastases in 7 (14.9%) cases. None of 8 patients (0%) with evaluable liver involvement regressed or stabilized on treatment for at least 6 months compared with 10 of 14 (71.4%) from the stomach, 7 of 7 (100%) from the small bowel, and 7 of 13 (53.8%) with mesenteric/omental involvement. These differences were statistically significant (P<0.001).
Conclusion
Apparent lack of response by tumours involving the liver could suggest that the kit, or by extrapolation PDGFR-alpha overexpression, may not be the factors activating kit or PDGFR-alpha targets in this subset of patients, or they could be of exon 9 mutation predominantly. Mutational analysis studies may shed more light in this issue.
Résumé
Introduction
Plus de 60 % des tumeurs stromales digestives (GIST) trouvent leur origine au niveau de l’estomac et environ 20 % au niveau de l’intestin grêle. Près de 95 % des GIST expriment le récepteur KIT à activité tyrosine-kinase (CD117) qui est utilisé à des fins de diagnostic et de traitement ciblé. Toutefois, la seule expression du récepteur KIT n’est pas spécifique aux GIST et n’implique pas nécessairement que la signalisation par la voie de la kinase KIT constitue l’événement déclencheur de l’oncogenèse. Parmi les facteurs de mauvais pronostic associés à une GIST, on peut citer l’atteinte du foie et d’autres organes volumineux.
Sujets et méthodes
Nous avons procédé à une analyse rétrospective portant sur des sujets atteints d’un léiomyosarcome positif au CD117, trouvant son origine au niveau de l’abdomen, et traités dans le cadre du Glivec International Patient Assistance Program (GIPAP) à l’hôpital de Nairobi entre le 7 novembre 2005 et le 22 novembre 2011. Résultats: Cinquante-quatre sujets au total ont été inclus dans l’étude: 36 hommes (66,7 %) et 18 femmes (33,3 %). Ils étaient âgés de 25 à 86 ans, avec un âge médian de 50 ans. L’estomac était primitivement touché dans 22 des 47 cas pouvant faire l’objet d’une évaluation (46,8 %). Le foie n’était primitivement touché que dans trois cas (6,4 %) et des métastases hépatiques étaient observées dans sept cas (14,9 %). Aucune régression ou stabilisation de la tumeur n’a été observée dans les six mois suivant le traitement chez les huit sujets (0 %) souffrant d’une atteinte hépatique et pouvant faire l’objet d’une évaluation. Il y a bien eu au contraire régression ou stabilisation chez 10 des 14 sujets (71,4 %) souffrant d’une atteinte gastrique, chez sept des sept (100 %) sujets souffrant d’une atteinte de l’intestin grêle et chez 7 des 13 sujets (53,8 %) souffrant d’une atteinte mésentérique/épiploïque. Ces différences étaient statistiquement significatives (p < 0,001).
Conclusion
L’absence apparente de réponse des tumeurs touchant le foie pourrait suggérer que la surexpression du récepteur KIT ou, par extrapolation, du récepteur PDGFRalpha peut ne pas constituer le facteur d’activation des cibles des récepteurs KIT ou PDGFR-alpha chez cette sous-population de sujets, ou qu’il pourrait principalement s’agir d’une mutation de l’exon 9. Des études d’analyse mutationnelle pourraient apporter quelques éclaircissements à cet égard.
Similar content being viewed by others
References
Miettinen M, Lasota J (2006) Gastrointestinal stromal tumours: a review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med 369:1466–1478
Rubin BP, Heinrich MC, Corless CL (2007) Gastrointestinal stromal tumour. Lancet 369:1731–1741
Furitsu T, Tsujimura T, Tono T, et al (1993) Identification of mutations in the coding sequence of the proto-oncogene c-kit in a human mast cell leukaemia cell line causing ligand-independent activation of c-KIT product. J Clin Invest 92:1736–1744
Longley BJ, Tyrell L, Lu SZ, et al (1996) Somatic c-KIT activating mutation in urticaria pigmentosa and aggressive mastocytosis: establishment of clonality in a human mast cell neoplasm. Nat Genet 12:312–314
Coffin CM, Dehner LP, Meis-Kindblom JM (1998) Inflammatory myofibroblastic tumour, inflammatory fibrosarcoma, and related lesions: an historical review with differential diagnostic considerations. Semin Diagn Pathol 15:102–110
Hornick JL, Fletcher CD (2002) Immunohistochemical staining for KIT (CD117) in soft tissue sarcomas is very limited in distribution. Am J Clin Pathol 117:188–193
DeMatteo RP, Lewis JJ, Leung D, et al (2000) Two hundred gastrointestinal stromal tumours: recurrence patterns and prognostic factors for survival. Ann Surg 231:51–58
DeMatteo RP, Ballman KV, Antonescu CR, et al (2009) Adjuvant imatinib mesylate after resection of localized, primary gastrointestinal stromal tumour: a randomized, double-blind, placebo-controlled trial. Lancet 373:1097–1104
Verweij J, Casali P, Zalcberg J, et al (2004) Progression-free survival in gastrointestinal stromal tumours with high-dose imatinib: randomized trial. Lancet 364:1127–1134
Blanke CD, Rankin C, Demetri GD, et al (2008) Phase III randomized, intergroup trial assessing imatinib mesylate at two dose levels in patients with unresectable gastrointestinal stromal tumours expressing the kit receptor tyrosine kinase: s0033. J Clin Oncol 26:626–632
Corless CL, Fletcher JA, Heinrich MC (2004) Biology of gastrointestinal stromal tumours. J Clin Oncol 22:3813–3825
Van Oosterom AT, Judson I, Verweij J, et al (2001) Safety and efficacy of imatinib (STI571) in metastatic gastrointestinal stromal tumours: a phase I study. Lancet 358:1421–1423
Blanke CD, Demetri GD, Von Mehren M, et al (2008) Long-term results from a randomized phase II trial of standard-versus higher-dose imatinib mesylate for patients with unresectable or metastatic gastrointestinal stromal tumours expressing KIT. J Clin Oncol 26:620–625
Longley BJ, Tyrrell L, Lu SZ, et al (1996) Somatic c-KIT activating mutation in urticaria pigmentosa and aggressive mastocytosis: establishment of clonality in a human mast cell neoplasm. Nat Genet 12:312–314
Joensuu H (2006) Sunitinib for imatinib resistant GIST. Lancet 368:1303–1304
Le Cesne A, Ray-Coquard I, Bui BN, et al (2010) Discontinuation of imatinib in patients with advanced gastrointestinal stromal tumours after 3 years of treatment: an open-label multicentre randomized phase III trial. Lancet Oncol 11:942–949
Heinrich MC, Corless CL, Demetri GD, et al (2003) Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumour. J Clin Oncol 21:4342–4349
Antonescu CR, Besmer P, Guo T, et al (2005) Acquired resistance to imatinib in gastrointestinal stromal tumour occurs through secondary gene mutation. Clin Cancer Res 11:4182–4190
Author information
Authors and Affiliations
Corresponding author
About this article
Cite this article
Othieno Abinya, N.A., Singh Riyat, M., Omollo, R. et al. Differences in response to imatinib between gastrointestinal stromal tumours involving the liver and tumours that do not: experience from Nairobi. J Afr Cancer 5, 79–83 (2013). https://doi.org/10.1007/s12558-013-0249-x
Received:
Accepted:
Published:
Issue Date:
DOI: https://doi.org/10.1007/s12558-013-0249-x